早教吧作业答案频道 -->化学-->
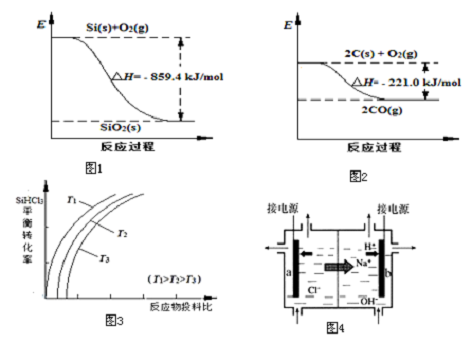
高纯晶体硅是信息技术的关键材料.(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=(2)粗硅经系
题目详情
高纯晶体硅是信息技术的关键材料.
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=___
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:___.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用___方法提纯SiHCl3.
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g)⇌Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图3所示.
下列说法正确的是___(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是___,b电极上的电极反应式是___.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=___.
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=___
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:___.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用___方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
下列说法正确的是___(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是___,b电极上的电极反应式是___.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=___.

▼优质解答
答案和解析
(1)根据两个反应过程能量变化图象可知:Si(s)+O2(s)═SiO2(s)△H=-859.4 kJ•mol-1
2C(s)+O2(s)═2CO(g)△H=-221.0 kJ•mol-1,用第二个方程式减去第一个方程式得出所需反应,SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1,得到△H=+638.4 kJ•mol-1,
故答案为:+638.4 kJ•mol-1;
(2)硅烷的分解温度远低于甲烷,是因为C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,
故答案为:C和Si最外层电子数相同,C原子半径小于Si;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法,故答案为:蒸馏(或分馏);
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
,故b错误;
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度,故c正确;
故选ac;
③阳极室是氯离子放电,所以阳极式应充入氯化钠,b电极是阴极,氢离子在该极放电,所以电极反应式是2H++2e-=H2↑,
故答案为:精制的饱和食盐水;2H++2e-═H2↑
(4)玻璃的化学组成可根据反应原理得到,
Na2CO3+SiO2
NaSiO3+CO2↑;CaCO3+SiO2
CaSiO3+CO2↑;
由化学式Na2SiO3•CaSiO3•xSiO2反应的Na2CO3和CaCO3的物质的量相等,
n(CO2)=n(Na2CO3)+n(CaCO3)=n(SiO2反应)=
=1000mol;
n(Na2CO3)=n(CaCO3)=500mol
500molNa2CO3的质量是53kg,500molCaCO3的质量是50kg,1000molSiO2的质量是60kg,
n(SiO2过量)=
=2000mol,
即剩余的二氧化硅和生成的硅酸钙、硅酸钠为2000:500:500=4:1:1,
所以x=4,故答案为:4.
2C(s)+O2(s)═2CO(g)△H=-221.0 kJ•mol-1,用第二个方程式减去第一个方程式得出所需反应,SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1,得到△H=+638.4 kJ•mol-1,
故答案为:+638.4 kJ•mol-1;
(2)硅烷的分解温度远低于甲烷,是因为C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,
故答案为:C和Si最外层电子数相同,C原子半径小于Si;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法,故答案为:蒸馏(或分馏);
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
| n(H2) |
| n(SiHCl3) |
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度,故c正确;
故选ac;
③阳极室是氯离子放电,所以阳极式应充入氯化钠,b电极是阴极,氢离子在该极放电,所以电极反应式是2H++2e-=H2↑,
故答案为:精制的饱和食盐水;2H++2e-═H2↑
(4)玻璃的化学组成可根据反应原理得到,
Na2CO3+SiO2
| ||
| ||
由化学式Na2SiO3•CaSiO3•xSiO2反应的Na2CO3和CaCO3的物质的量相等,
n(CO2)=n(Na2CO3)+n(CaCO3)=n(SiO2反应)=
| 44kg |
| 44g |
n(Na2CO3)=n(CaCO3)=500mol
500molNa2CO3的质量是53kg,500molCaCO3的质量是50kg,1000molSiO2的质量是60kg,
n(SiO2过量)=
| 283kg-50kg-53kg-60kg |
| 60g |
即剩余的二氧化硅和生成的硅酸钙、硅酸钠为2000:500:500=4:1:1,
所以x=4,故答案为:4.
看了 高纯晶体硅是信息技术的关键材...的网友还看了以下:
每个应用题都有三个根据叫什么列:童话书每本17.8元,科技书每本比童话书少2.3元,求科技书多少元 2020-05-14 …
求黄河水含砂量.为测定黄河水的含砂量是多少,某同学取了10立方分米的黄河水,称得其质量为10.18 2020-06-29 …
1.简述网络通信的工作原理是什么?1、计算机网络是()相结合的产物。A、计算机技术与通讯技术B、计 2020-07-04 …
某碎屑岩,砾石15%,中砂60%,粉砂25%,细砂2%,定名为 2020-07-10 …
无奈的2道题1.某图书馆有科技书,文艺书共630本.其中科技书占20%,后来又买进一批科技书,这时 2020-07-12 …
有一些相同的房间需要粉刷墙面,2名一级技工3天可粉刷8个房间,结果其中有50平方米墙面没来得及粉刷 2020-07-16 …
计算砼基准配合比,要求设计:砼强度等级为C30,坍落度为35-50MM的砼配合比已知条件:水泥强度 2020-07-30 …
生物芯片属于什么学科的产品?1.电子焊接与生物技术2.生物科技与半导体科技3.电子技术与空间技术4. 2020-11-04 …
请用下面七种技巧写七种作文开头,一种写一段开头.技巧1;点题法技巧2;巧用修辞技巧3;精彩描写技巧4 2020-11-28 …
1.对于高层管理者来说,以下哪种技能应该占较大比重a.人际技能b.关系技能c.概念技能d.技术技能2 2020-12-09 …