早教吧作业答案频道 -->化学-->
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,溶于水即生成NaHSO3.实验室可利用二氧化硫与亚硫酸钠反应制备焦亚硫酸钠.某研究
题目详情
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,溶于水即生成NaHSO3.实验室可利用二氧化硫与亚硫酸钠反应制备焦亚硫酸钠.
某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置II中有黄色晶体析出.
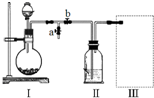
(1)装置 I中产生气体的化学方程式为___.
(2)要从装置II中获得已析出的晶体,在实验室中需要使用到的玻璃仪器是:___.
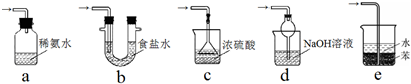
(3)装置 III用于处理尾气,防止污染环境.下列装置中,可选用的最合理装置(夹持仪器已略去)为___(填序号).
实验二:焦亚硫酸钠的性质
(4)将Na2S2O5溶于水配成溶液,
①欲证明所得溶液中的离子浓度大小关系:c(SO32-)>c(H2SO3),下列选项中可采用的实验方法是___
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测 f.加入BaCl2溶液
②检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g•L-1.
②在上述实验过程中,若有部分HI被空气氧化,则测得结果___(填“偏高”“偏低”或“不变”).
某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置II中有黄色晶体析出.

(1)装置 I中产生气体的化学方程式为___.
(2)要从装置II中获得已析出的晶体,在实验室中需要使用到的玻璃仪器是:___.
(3)装置 III用于处理尾气,防止污染环境.下列装置中,可选用的最合理装置(夹持仪器已略去)为___(填序号).

实验二:焦亚硫酸钠的性质
(4)将Na2S2O5溶于水配成溶液,
①欲证明所得溶液中的离子浓度大小关系:c(SO32-)>c(H2SO3),下列选项中可采用的实验方法是___
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测 f.加入BaCl2溶液
②检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g•L-1.
②在上述实验过程中,若有部分HI被空气氧化,则测得结果___(填“偏高”“偏低”或“不变”).
▼优质解答
答案和解析
实验一:该装置II中有黄色晶体析出,则II中为SO2和NaHSO3反应生成,则I中发生反应生成SO2,
(1)实验室用亚硫酸钠和稀硫酸反应制取SO2,同时生成硫酸钠或硫酸氢钠,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O;
(2)分离固体和溶液采用过滤方法,根据各仪器作用选取仪器,用漏斗过滤、用玻璃棒引流、用烧杯盛放液体,所以选取的仪器为漏斗、玻璃棒、烧杯,故答案为:玻璃棒、漏斗、烧杯;
(3)装置 III用于处理尾气,防止污染环境,尾气为二氧化硫,属于酸性氧化物,能和碱反应生成盐而防止污染环境,注意要防止倒吸,
a.二氧化硫极易溶于氨水,但因为二氧化硫不能和氨水充分接触,所以不能用该装置吸收二氧化硫,故错误;
b.亚硫酸酸性小于盐酸,所以二氧化硫不易溶于食盐水,故错误;
c.二氧化硫和浓硫酸不反应,不易溶于浓硫酸,故错误;
d.二氧化硫极易溶于氢氧化钠溶液,且该装置具有缓冲作用,能防止倒吸,故正确;
e.二氧化硫能溶于水但不易溶于苯,能防止倒吸,但二氧化硫在水溶液中溶解度较小,所以不能作尾气处理装置,故错误;
故选d;
实验二:(4)Na2S2O5溶于水分解生成SO2和NaHSO3,
①NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
②Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,其检验方法为:取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成;
实验三:(5)①令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
=0.16 g/L
故答案为:0.16;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏低,故答案为:偏低.
(1)实验室用亚硫酸钠和稀硫酸反应制取SO2,同时生成硫酸钠或硫酸氢钠,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O;
(2)分离固体和溶液采用过滤方法,根据各仪器作用选取仪器,用漏斗过滤、用玻璃棒引流、用烧杯盛放液体,所以选取的仪器为漏斗、玻璃棒、烧杯,故答案为:玻璃棒、漏斗、烧杯;
(3)装置 III用于处理尾气,防止污染环境,尾气为二氧化硫,属于酸性氧化物,能和碱反应生成盐而防止污染环境,注意要防止倒吸,
a.二氧化硫极易溶于氨水,但因为二氧化硫不能和氨水充分接触,所以不能用该装置吸收二氧化硫,故错误;
b.亚硫酸酸性小于盐酸,所以二氧化硫不易溶于食盐水,故错误;
c.二氧化硫和浓硫酸不反应,不易溶于浓硫酸,故错误;
d.二氧化硫极易溶于氢氧化钠溶液,且该装置具有缓冲作用,能防止倒吸,故正确;
e.二氧化硫能溶于水但不易溶于苯,能防止倒吸,但二氧化硫在水溶液中溶解度较小,所以不能作尾气处理装置,故错误;
故选d;
实验二:(4)Na2S2O5溶于水分解生成SO2和NaHSO3,
①NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
②Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,其检验方法为:取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成;
实验三:(5)①令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
| 0.016g |
| 0.1L |
故答案为:0.16;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏低,故答案为:偏低.
看了 焦亚硫酸钠(Na2S2O5)...的网友还看了以下:
某硫酸厂用接触法制硫酸的生产过程中,在煅烧黄铁矿时损失硫5%(质量分数);在SO2的催化氧化时有9 2020-04-27 …
氯水和氢氧化钠反应的离子方程式氯化铁溶液和氢氧化钾氯化铁和氨水硫酸镁和氢氧化钡大理石和醋酸硫酸和氢 2020-05-13 …
接触法制硫酸的生产工艺中,各阶段主要设备的名称正确的是()A.硫磺或硫铁矿的燃烧-沸腾焙烧炉B.二 2020-07-06 …
关于铜的几个方程式1.氯化铜生成氧化铜2.硫酸铜生成硝酸铜3.碱式碳酸铜生成硫酸铜4.碱式碳酸铜生成 2020-11-01 …
化学酸和碱的知识化学方程式硫酸与金属氧化物生成盐和水的化学方程式.硫酸与盐生成另一种酸和另一种盐的化 2020-11-15 …
(11分)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了 2020-11-28 …
氧化钙和硫酸钠反应要用氧化钙排硫酸钠,怎么排不可能直接生成硫酸钙和氢氧化钠吧.能不能帮我分析分析,如 2020-12-12 …
某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置, 2021-02-01 …
有下列反应.1:铁和硫酸铜生成铜和硫酸铁.2:氧化钙和水生成氢氧化钙.3:氢氧化钡和硫酸生成硫酸和水 2021-02-09 …
1.锌和稀盐酸反应生成氯化锌和氢气.2.铝和稀硫酸反应生成硫酸铝和氢气.3.硫酸铜和氢氧化钾反应,生 2021-02-14 …