早教吧作业答案频道 -->化学-->
MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:(1)第①步反应中的硫酸能否用浓盐酸代替?(填“能”或“否”),理由是
题目详情
MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
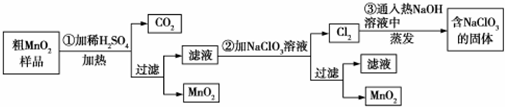
(1)第①步反应中的硫酸能否用浓盐酸代替?___(填“能”或“否”),理由是___.
(2)第②步操作中,氧化性强弱顺序:ClO3-___MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式:___;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol.
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH.
①制取K2MnO4的化学反应方程式为___,工业上不断搅拌的目的是___.
②电解K2MnO4的浓溶液时,电解的总反应方程式为___.
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3═2NaI+Na2S4O6
取较为纯净的二氧化锰样品ag加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为___%(杂质不参与反应).

(1)第①步反应中的硫酸能否用浓盐酸代替?___(填“能”或“否”),理由是___.
(2)第②步操作中,氧化性强弱顺序:ClO3-___MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式:___;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol.
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH.
①制取K2MnO4的化学反应方程式为___,工业上不断搅拌的目的是___.
②电解K2MnO4的浓溶液时,电解的总反应方程式为___.
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3═2NaI+Na2S4O6
取较为纯净的二氧化锰样品ag加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为___%(杂质不参与反应).
▼优质解答
答案和解析
(1)二氧化锰有氧化性,在加热时浓盐酸能被MnO2氧化生成Cl2,所以不能用盐酸代替硫酸,
故答案为:否;浓盐酸能被MnO2氧化生成Cl2;
(2)操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;1;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,反应的方程式为2MnO2+4KOH+O2=2 K2MnO4+2H2O,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触,
故答案为:2MnO2+4KOH+O2=2 K2MnO4+2H2O;使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气,电解的总反应方程式为2 K2MnO4+2H2O═KMnO4+2KOH+H2↑,
故答案为:2 K2MnO4+2H2O═KMnO4+2KOH+H2↑;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据题意可知Na2S2O3的物质的量为0.1000mol/L×0.001VL=0.0001Vmol,所以二氧化锰的质量为0.0001Vmol×87g/mol×
=0.00435Vg,则该样品中MnO2含量为
×100%=
%,
故答案为:
.
故答案为:否;浓盐酸能被MnO2氧化生成Cl2;
(2)操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;1;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,反应的方程式为2MnO2+4KOH+O2=2 K2MnO4+2H2O,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触,
故答案为:2MnO2+4KOH+O2=2 K2MnO4+2H2O;使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气,电解的总反应方程式为2 K2MnO4+2H2O═KMnO4+2KOH+H2↑,
故答案为:2 K2MnO4+2H2O═KMnO4+2KOH+H2↑;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据题意可知Na2S2O3的物质的量为0.1000mol/L×0.001VL=0.0001Vmol,所以二氧化锰的质量为0.0001Vmol×87g/mol×
| 1 |
| 2 |
| 0.00435Vg |
| ag |
| 0.435V |
| a |
故答案为:
| 0.435V |
| a |
看了 MnO2是一种重要的化工原料...的网友还看了以下:
高手帮忙写英语作文5月4日,高三年1班和2班之间将进行一场有关环保问题的演讲比赛(atalksho 2020-04-08 …
数学比的应用,前后项,中间的是什么?比如说2:3,2是前项,3是后项,如果是2:3:4,2、3、4 2020-04-09 …
分式的加减先化简,再求值:y^2/y-2加上4/2-y,其中Y=-9/2已知y=-2/3,求1+y 2020-05-13 …
盒子装有15个球分别写着1-15各数,假如摸到2的倍数,小刚赢.假如不是2的倍数,小强赢,这样的比 2020-05-13 …
1的平方是几啊?几年级的问题,谁能回答.如果是2那么为什么,如果是1,那么2的平方怎么解释,谁能回 2020-05-13 …
求红警三中每个单位的讲话及中文翻译如果是2带的话就不必费事贴上来了.尽可能全,我会追加分.谢一楼, 2020-05-14 …
设置一个时间函数以30分为分界线取整,例如:如果是2小时15分,则显示2小时,如果是2小时50,则 2020-05-17 …
在二次型中 正交化换为标准型 特征向量的顺序怎么排列啊?标准化以后的二次型的平方项系数如果是2 4 2020-05-17 …
盒子装有15个球分别写着1-15各数,假如摸到2的倍数,小刚赢.假如不是2的倍数,小强赢,这样的比 2020-05-22 …
二分之三乘a+b分之5b²应该怎么算?我的主要问题是2乘a+b是怎么算,注意是分数形式,如果是2乘 2020-06-03 …