早教吧作业答案频道 -->化学-->
二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物
题目详情
二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图:
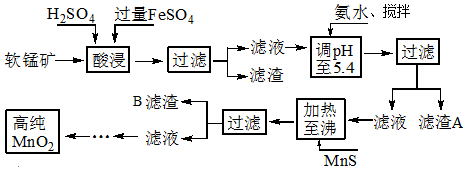
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为___.
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是___.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为___
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为___.

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是___.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为___
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为___.
▼优质解答
答案和解析
软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰,
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+,滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.4,恰好能使Fe3+、Al3+沉淀完全,
故答案为:充分氧化过量的Fe2+;5.4;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,滤渣B的成分是CuS、ZnS,
故答案为:CuS、ZnS;
(4)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O═MnO2+4H+;
(6)准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),
则得到:MnO2~I2~2S2O32-,
1 2
n 0.025.00L×0.0800mol•L-1×
n=0.005mol,
计算可得该样品MnO2纯度=
×100%=94.6%,
故答案为:94.6%;
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+,滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.4,恰好能使Fe3+、Al3+沉淀完全,
故答案为:充分氧化过量的Fe2+;5.4;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,滤渣B的成分是CuS、ZnS,
故答案为:CuS、ZnS;
(4)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O═MnO2+4H+;
(6)准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),
则得到:MnO2~I2~2S2O32-,
1 2
n 0.025.00L×0.0800mol•L-1×
| 100ml |
| 20ml |
n=0.005mol,
计算可得该样品MnO2纯度=
| 0.005mol×87g/mol |
| 0.4600g |
故答案为:94.6%;
看了 二氧化锰是制造锌锰干电池的基...的网友还看了以下:
《煤矿安全规程》规定井下CO浓度最大允许值为0.0024%,为什么有的资料上却写着0.02%呢?是错 2020-03-30 …
(10分)榴石矿石可以看作组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:(1)榴石矿加盐酸溶解 2020-04-06 …
根据铝土矿(主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质)生产铝的流程图回答下列 2020-05-13 …
我有一块矿金带有红色和黑色.这还是叫矿金吗?还是什么金.找人要这块矿金. 2020-05-17 …
有关岩石的选择题.有明显的矿物晶体颗粒和气孔的岩石,往往还具有(.)A柱状结构B片有关岩石的选择题 2020-05-20 …
土壤中含有有机物还是有机质我现在这可还没有上到有的书上写土壤由有机物,矿物质.水,空气组成有的写由 2020-06-05 …
除了水份还有什么在100度-200左右可以蒸发!矿物质我有一种矿物质,其锰含量40度,在页岩之中,矿 2020-11-16 …
我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土 2020-11-30 …
海底的资源非常丰富,不仅含有常规的化石燃料---、、,还含有新发现的新型矿产资源--,又称为,还被科 2020-12-07 …
2013年6月,我国“蛟龙”号再次刷新“中国深度”--下潜7062米,为我国深海矿物资源的开发奠定了 2020-12-07 …