早教吧作业答案频道 -->化学-->
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示.
题目详情
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示.请计算:
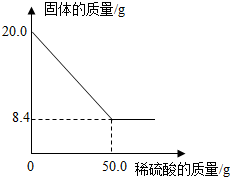
(1)20.0g菱铁矿中FeCO3的质量为___g;
(2)恰好完全反应时,所得溶液的溶质质量分数(结果准确到0.1%)

(1)20.0g菱铁矿中FeCO3的质量为___g;
(2)恰好完全反应时,所得溶液的溶质质量分数(结果准确到0.1%)
▼优质解答
答案和解析
(1)20.0g菱铁矿中FeCO3的质量为:20.0g-8.4g=11.6g;
(2)设生成FeSO4质量为x,CO2质量为y
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 142 44
11.6g x y
=
=
x=14.2g
y=4.4g
所得溶液的质量为:11.6g+50g-4.4g=57.2g
所得溶液的溶质质量分数为:
×100%≈24.8%.
故答案为:(1)11.6g;
(2)所得溶液的溶质质量分数为24.8%.
(2)设生成FeSO4质量为x,CO2质量为y
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 142 44
11.6g x y
| 116 |
| 11.6g |
| 142 |
| x |
| 44 |
| y |
x=14.2g
y=4.4g
所得溶液的质量为:11.6g+50g-4.4g=57.2g
所得溶液的溶质质量分数为:
| 14.2g |
| 57.2g |
故答案为:(1)11.6g;
(2)所得溶液的溶质质量分数为24.8%.
看了 菱铁矿(主要成分是FeCO3...的网友还看了以下:
治疗宝宝咳嗽痰稀的中医小偏方 2020-03-29 …
已知:101kPa时的辛烷的燃烧热为5518kJ•mol-1,强酸与强碱在稀溶液中发生反应时的中和 2020-04-08 …
已知101KPa时的辛烷的燃烧热为5518kJ/mol,强酸与强碱在稀溶液中发生反应时的中和热为5 2020-04-08 …
已知101KPa时的辛烷的燃烧热为5518kJ/mol,强酸与强碱在稀溶液中发生反应时的中和热为5 2020-04-08 …
数学三角形全等题...急重奖需要讲解.当两个三角形全等时,下列说法不正确的是:A、.对应边的中线相 2020-05-23 …
静止在匀强磁场中的锂核俘获一个速度为7.7×104m/s的中子而发生核反应,反应中放出的α粒子的速 2020-06-14 …
选修3-5选做题静止的锂核63Li俘获一个速度为8×106m/s的中子,发生核反应后若只产生了两个 2020-06-20 …
静止的锂核(63Li)俘获一个速度为7.7×106m/s的中子,发生核反应后若只产生两个新粒子,其 2020-06-20 …
静止在匀强磁场中的锂核63Li俘获一个速度为7.7×104m/s的中子而发生核反应,反应中放出α粒 2020-06-20 …
(2013•江苏一模)静止的锂核63Li俘获一个速度为8×106m/s的中子,发生核反应后产生了两 2020-06-20 …