早教吧作业答案频道 -->化学-->
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:已知:生成氢氧化物沉淀的pHMn(OH)2Fe(OH)2Fe(OH)3Cu(OH)2开始沉
题目详情
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
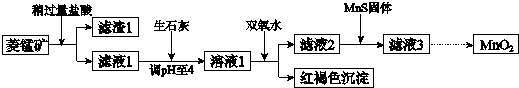
已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是___.盐酸溶解MnCO3的化学方程式是___.
(2)向溶液1中加入双氧水时,反应的离子方程式是___.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是___.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+___=___+___+___.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是___.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是___.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是___.

已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是___.盐酸溶解MnCO3的化学方程式是___.
(2)向溶液1中加入双氧水时,反应的离子方程式是___.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是___.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+___=___+___+___.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是___.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是___.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是___.
▼优质解答
答案和解析
菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,系列转化得到MnO2.
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水,反应方程式为:MnCO3+2HCl=MnCl2+CO2↑+H2O,
故答案为:增大接触面积,提高反应速率;MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+,
故答案为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁,反应离子方程式为:MnS+Cu2+=Mn2++CuS,
故答案为:MnS+Cu2+=Mn2++CuS;
(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+,
故答案为:4H2O;Cl2↑;5MnO2;8H+;
(5)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
②生成氯气发生氧化反应,在阳极产生,检验Cl2的操作是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成,
故答案为:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成;
③Mn2+、Cl-都在阳极放电,二者为竞争关系,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电),
故答案为:其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水,反应方程式为:MnCO3+2HCl=MnCl2+CO2↑+H2O,
故答案为:增大接触面积,提高反应速率;MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+,
故答案为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁,反应离子方程式为:MnS+Cu2+=Mn2++CuS,
故答案为:MnS+Cu2+=Mn2++CuS;
(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+,
故答案为:4H2O;Cl2↑;5MnO2;8H+;
(5)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
②生成氯气发生氧化反应,在阳极产生,检验Cl2的操作是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成,
故答案为:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成;
③Mn2+、Cl-都在阳极放电,二者为竞争关系,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电),
故答案为:其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
看了 工业上用菱锰矿(MnCO3)...的网友还看了以下:
圆内接正三角形ABC的中心为O,半径为R,将其沿直线L向右翻滚,当正三角形滚一周时,其中心O经过的 2020-04-11 …
1.PT切圆O于T,CT为直径,D为OC上的一点,支线PD交圆O于B和A,B在线段PD上,若CD= 2020-04-12 …
O、A、B、C为空间四个点,又OA、OB、OC为空间的一个基底,则()A.O、A、B、C四点不共线 2020-05-14 …
∵EM是⊙O的切线,怎么推出EB•EC=EM2①?,看题后回答.(2005•温州)如图,已知四边形 2020-05-21 …
色谱在其它条件不变得情况下,若柱长增加一倍,色谱峰的宽度为原色谱峰宽度的在其它条件不变得情况下, 2020-06-18 …
如图所示为一长为L的均匀导线,现将其中点O悬挂起来得到平衡,如果将它的右半段弯折过来,使右端点与导 2020-06-26 …
请翻成白话文其一七绝崎岖世路已难行,况复衰颓马望成,远道瑶章多策勉,内心愧感莫能京.其二七绝白首心 2020-07-03 …
大气臭氧层的反应是:O+O3=2O2△H,该反应的能量变化如图所示,下列叙述中,正确的是()A.O+ 2020-10-31 …
如图所示,要测水池中一荷花E距岸边A和岸边D的距离.作法如下:(1)任作线段AB,取其中点O;(2) 2020-11-01 …
此日,O和P两地风力大小差别大,其主要原因是()①P等压线比O密集,P水平气压梯度力大②O等压线比P 2021-01-08 …