早教吧作业答案频道 -->化学-->
为测定菱铁矿石中碳酸亚铁的含量(假设其中杂质的成分不溶于水,也不参加反应),某化学小组进行如下的实验:(1)用36.5%的浓盐酸配制100g14.6%的稀盐酸加入水的质量是.(2)写出未
题目详情
为测定菱铁矿石中碳酸亚铁的含量(假设其中杂质的成分不溶于水,也不参加反应),某化学小组进行如下的实验:
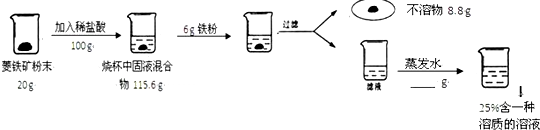
(1)用36.5%的浓盐酸配制100g14.6%的稀盐酸加入水的质量是___.
(2)写出未将盐酸完全耗尽的发生反应的化学方程式___;
(3)根据已知条件列出该菱铁矿石中发生反应的物质的质量(x)的比例式___;
(4)该菱铁矿石中碳酸亚铁的含量是___;
(5)最终烧杯中溶液中溶质的质量分数为25%,则过滤后需蒸发水的质量是___;
(6)欲将该菱铁矿含杂质4%的生铁2800t,若生成过程中有20%的铁被损耗,则需要该菱铁矿石的质量是___t.
(1)用36.5%的浓盐酸配制100g14.6%的稀盐酸加入水的质量是___.
(2)写出未将盐酸完全耗尽的发生反应的化学方程式___;
(3)根据已知条件列出该菱铁矿石中发生反应的物质的质量(x)的比例式___;
(4)该菱铁矿石中碳酸亚铁的含量是___;
(5)最终烧杯中溶液中溶质的质量分数为25%,则过滤后需蒸发水的质量是___;
(6)欲将该菱铁矿含杂质4%的生铁2800t,若生成过程中有20%的铁被损耗,则需要该菱铁矿石的质量是___t.

▼优质解答
答案和解析
(1)设配制100g14.6%的稀盐酸加入水的质量是为x,则根据稀释前后溶质的质量不变可得:
100g×14.6%=(100g-x)×36.5%
x=60g;
(2)碳酸亚铁和盐酸反应生成氯化亚铁、水和二氧化碳,化学方程式为:FeCO3+2HCl=FeCl2+H2O+CO2↑;
(3)生成二氧化碳的质量为:20g+100g-115.6g=4.4g
设菱铁矿石中发生反应的物质的质量为x
FeCO3+2HCl=FeCl2+H2O+CO2↑;
116 44
x 4.4g
=
x=11.6g
(4)该菱铁矿石中碳酸亚铁的含量是
×100%=58%;
(5)生成氯化亚铁的质量为y
2HCl----FeCl2,
73 127
100g×14.6% y
=
x=25.4g
所以反应后溶液的质量为:
=101.6g
通过计算可知,碳酸亚铁中含有杂质质量为20g-11.6g=8.4g,所以不溶物中包括杂质和没有反应的铁,所以参加反应的铁的质量6g-(8.8g-8.4g)=5.6g,生成氢气的质量为0.2g,所以蒸发水的质量为:115.6g+6g--8.8g-0.2g-101.6g=11g;
(6)设需要该菱铁矿石的质量是z
FeCO3--------Fe
116 56
z×58%(1-20%) 2800t×(1-4%)
=
z=12000t.
故答案为:(1)60g;
(2)FeCO3+2HCl=FeCl2+H2O+CO2↑;
(3)
=
;
(4)58%;
(5)11g;
(6)12000t.
100g×14.6%=(100g-x)×36.5%
x=60g;
(2)碳酸亚铁和盐酸反应生成氯化亚铁、水和二氧化碳,化学方程式为:FeCO3+2HCl=FeCl2+H2O+CO2↑;
(3)生成二氧化碳的质量为:20g+100g-115.6g=4.4g
设菱铁矿石中发生反应的物质的质量为x
FeCO3+2HCl=FeCl2+H2O+CO2↑;
116 44
x 4.4g
| 116 |
| x |
| 44 |
| 4.4g |
x=11.6g
(4)该菱铁矿石中碳酸亚铁的含量是
| 11.6g |
| 20g |
(5)生成氯化亚铁的质量为y
2HCl----FeCl2,
73 127
100g×14.6% y
| 73 |
| 100g×14.6% |
| 127 |
| x |
x=25.4g
所以反应后溶液的质量为:
| 25.4g |
| 25% |
通过计算可知,碳酸亚铁中含有杂质质量为20g-11.6g=8.4g,所以不溶物中包括杂质和没有反应的铁,所以参加反应的铁的质量6g-(8.8g-8.4g)=5.6g,生成氢气的质量为0.2g,所以蒸发水的质量为:115.6g+6g--8.8g-0.2g-101.6g=11g;
(6)设需要该菱铁矿石的质量是z
FeCO3--------Fe
116 56
z×58%(1-20%) 2800t×(1-4%)
| 116 |
| z×58%×(1-20%) |
| 56 |
| 2800t×(1-4%) |
z=12000t.
故答案为:(1)60g;
(2)FeCO3+2HCl=FeCl2+H2O+CO2↑;
(3)
| 116 |
| x |
| 44 |
| 4.4g |
(4)58%;
(5)11g;
(6)12000t.
看了 为测定菱铁矿石中碳酸亚铁的含...的网友还看了以下:
下列有关盐类水解的说法中,正确的是()A.所有的盐在水溶液中都能水解B.盐类水解一定都显酸性或碱性 2020-05-14 …
一桶盐水,其中水重80千克,盐重20千克,盐占盐水质量的()%,水占盐水质量的()%,盐和水共占盐 2020-05-22 …
CO2可以被封存在地下盐水层,最终转化为固态碳酸盐,其与水反应的化学方程式为: 2020-06-22 …
做实验;在玻璃杯中放些水,将鸡蛋放入其中,将一勺食盐放入水中,用小棒搅拌一下,继续往水中加盐,并用 2020-06-27 …
A盐水的重量为15千克,其中盐占40%,水占60%;B盐水的重量为10千克,其中盐占30%,水占7 2020-07-07 …
一瓶盐水,将其中盐的25%换成水,同时将其中水的25%换成盐,这时这瓶盐溶液的浓度为70%,问原盐 2020-07-12 …
一杯盐水,其中水重85克,盐重15克,盐占盐水质量的()%,水占盐水质量的()%,盐和水共沾盐水质 2020-07-18 …
下列有关盐类水解的叙述中正确的是()A.溶液呈中性的盐一定是强酸、强碱生成的盐B.含有弱酸根盐的水 2020-07-25 …
一个非常纠结的问题:盐水浓度问题现有一瓶盐水,如果把其中盐的25%换成水,同时把其中水的25%换成盐 2020-12-07 …
1、用盐水选中需要密度为1.1×10^3kg/m^3的盐水,现配制了500ml的盐水,称得其质量为0 2021-01-31 …