早教吧作业答案频道 -->化学-->
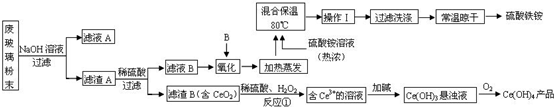
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质).某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:已知:ⅰ.酸性
题目详情
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质).某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性.
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4)3•b(NH4)2SO4•cH2O]广泛用于水的净化处理.
(1)操作Ⅰ的名称是___,检验硫酸铁铵溶液中含有NH4+的方法是:___.
(2)反应①之前先要洗涤滤渣B,其目的是为了除去___(填离子符号).
(3)写出反应①的化学方程式___.
(4)用滴定法测定制得的Ce(OH)4产品纯度.

滴定时所用定量仪器的读数精确为___;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数___.(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应.则该硫酸铁铵的化学式为___.

已知:
ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性.
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4)3•b(NH4)2SO4•cH2O]广泛用于水的净化处理.
(1)操作Ⅰ的名称是___,检验硫酸铁铵溶液中含有NH4+的方法是:___.
(2)反应①之前先要洗涤滤渣B,其目的是为了除去___(填离子符号).
(3)写出反应①的化学方程式___.
(4)用滴定法测定制得的Ce(OH)4产品纯度.

滴定时所用定量仪器的读数精确为___;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数___.(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应.则该硫酸铁铵的化学式为___.
▼优质解答
答案和解析
废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4.
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶,检验硫酸铁铵溶液中含有NH4+,方法为取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,
故答案为:冷却结晶; 取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,试纸变蓝色,证明含有NH4+;
(2)滤渣A的成分是Fe2O3、CeO2、FeO,与硫酸反应后溶液中存在Fe3+、Fe2+,固体表面可吸附Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2,反应的方程式为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,
故答案为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O;
(4)滴定时所用定量仪器的最小刻度为0.1mL,估读0.01ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会偏大;
故答案为:0.1mL;偏大;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)
=0.01mol,生成氢氧化铁沉淀物质的量为,n(Fe(OH)3)=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=
=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,
故答案为:Fe2(SO4)3•2(NH4)2SO4•2H2O.
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶,检验硫酸铁铵溶液中含有NH4+,方法为取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,
故答案为:冷却结晶; 取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,试纸变蓝色,证明含有NH4+;
(2)滤渣A的成分是Fe2O3、CeO2、FeO,与硫酸反应后溶液中存在Fe3+、Fe2+,固体表面可吸附Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2,反应的方程式为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,
故答案为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O;
(4)滴定时所用定量仪器的最小刻度为0.1mL,估读0.01ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会偏大;
故答案为:0.1mL;偏大;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)
| 1.6g |
| 160g/mol |
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=
| 0.72g |
| 18g/mol |
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,
故答案为:Fe2(SO4)3•2(NH4)2SO4•2H2O.
看了 平板电视显示屏生产过程中产生...的网友还看了以下:
下列实验操作正确的是[]A.用托盘天平称取5.66g食盐粉末B.把烧杯放在铁圈上直接加热C.把易潮 2020-05-17 …
下列实验操作正确的是()A.用托盘天平称取5.66g食盐粉末B.把烧杯放在铁圈上直接加热C.把易潮 2020-05-17 …
坐在船上的人用桨向后划水时,船就会前进.使船前进的力是()A.人手作用在桨上的力B.水作用于桨上的 2020-07-04 …
某同学为兑现自己在期末考试中数学得高分的承诺而修改考试成绩,欺骗父母,对此评价正确的是A.善意的谎言 2020-11-23 …
关于时间和时刻,下列说法正确的是()A.第4s末到第5s初经历了1s的时间B.物体在前4s内指的是物 2020-11-24 …
大国手清朝末年,围棋界出现两大泰斗,一人姓施名恩,住上海;一人姓林名海,居京城.两人被誉为“南施北林 2020-12-04 …
(13分)阅读材料,回答问题。材料一生之有时,而用之无度,则物力必屈……今背本而趋末,食者甚众,是天 2020-12-14 …
一本书标有2011页,从第一页开始每11页就在最后一页的页面加注一个红圈,直到末页.然后从末页开始向 2020-12-28 …
一本书标有2011页,从第一页开始每11页就在最后一页的页面加注一个红圈,直到末页.然后从末页开始向 2020-12-28 …
本书标有2011页,从第一页开始每11页就在最后一页的页面加注一个红圈,直到末页.然后从末页开始向前 2020-12-28 …