磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。⑴CaSO4·2H2O脱水反应相关的热化学方程式为:CaSO4·2H2O(s)=CaSO4·H2O(s)+H2O(g)ΔH1=83.2kJ·mol-1CaSO4&
磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·![]() H2O(s)+
H2O(s)+![]() H2O(g) ΔH1=83.2 kJ·mol-1
H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O![]() (g)=H2O(l) ΔH3=-44 kJ·mol-1
(g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·![]() H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ ![]() H2O(g)的ΔH4= ▲ kJ·mol-1。
H2O(g)的ΔH4= ▲ kJ·mol-1。
 ⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
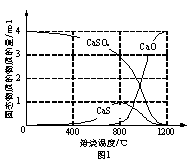
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如右图1所示。在低于800 ℃时主要还原产物为 ▲ ;高于800 ℃时主要发生的反应的化学方程式为
▲ 。
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是 ▲ ;当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是 ▲ 。
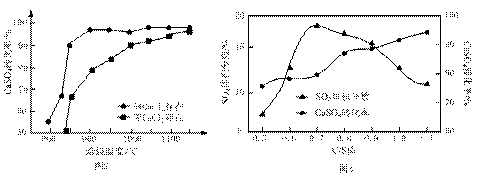
③以C作还原剂,向密闭容器中加入相同质量的![]() 几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100 ℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是
几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100 ℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是
▲ 。
⑶利用反应CaSO4(s)+(NH4)2CO3(aq)![]() CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)= ▲ 。
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)= ▲ 。
.⑴30.8
⑵①CaS CaS+3CaSO4![]() 4CaO+4SO2↑
4CaO+4SO2↑
②作催化剂 两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动
③高温下,过量的C与CO2反应生成CO,使气体总体积增大(或部分转化为其他含硫物质)
⑶1.75×10-2 mol·L-1
初二下册分式难题小明与小亮在一条东西向的马路边上,从同一地点出发向东跑步,速度分别为v1=1.5m 2020-05-13 …
对于共享锁(S)和排他锁(X)来说,下面列出的相容关系中,不正确的是()。A.S/X:FALSEB. 2020-05-24 …
s=vt,v=s/t,t=s/v哪个是基本公式?其实我是想问.比如v=s/t那按数学来推不是vt= 2020-06-12 …
如图是用如图是用若干花盆摆成的三角形图案,每条边为N个花盆(N>1)总数为s盆N=2,S=3N=3 2020-06-19 …
已知传递函数 G(S)=6s2+1/s3+3s2+3s=1 H(S)=(s+1)(s+2)/(s+ 2020-06-27 …
磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。⑴CaSO4·2H2O脱水反应 2020-07-17 …
通过下列两种反应都可以由赤铁矿生产铁:①Fe2O3(s)+C(s)2Fe(s)+CO2(g)ΔH( 2020-07-19 …
下列描述中正确的是()A.已知:P4(白磷,s)═4P(红磷,s),△H<0,则白磷比红磷稳定B. 2020-07-19 …
如图是由若干个大小相同的小正方体堆砌而成的几何体,若其主视图、左视图、俯视图的面积分别用S主,S左 2020-08-01 …
已知C(石墨,s)=C(金刚石,s)△H1>0,P(白磷,s)=P(红磷,s)△H2<0下列判断正确 2020-12-24 …