早教吧作业答案频道 -->化学-->
根据下列叙述写出相应的热化学方程式:(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:.(2)如图1是298K、101kPa时,N2与H2反应过程中能量变化的曲
题目详情
根据下列叙述写出相应的热化学方程式:
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:___.
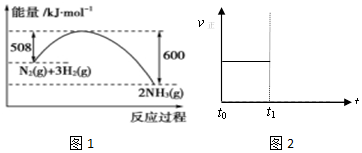
(2)如图1是298K、101kPa时,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式___.
(3)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:
C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.3kJ•mol-1
①若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1molH2O(g)和足量C(s),H2O(g)的平衡转化率为___
②对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___.
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
③上述反应达到平衡后,移走体系中部分C(s),平衡___,将产生的CO全部移走,平衡___(以上两空选填“向左移”、“向右移”、“不移动”).
④上述反应在t0时刻达到平衡(如图2),若在t1时刻改变某一条件,请在图2中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①增大容器体积(用实线表示) ②升高温度(用虚线表示)

(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:___.
(2)如图1是298K、101kPa时,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式___.
(3)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:
C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.3kJ•mol-1
①若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1molH2O(g)和足量C(s),H2O(g)的平衡转化率为___
②对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___.
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
③上述反应达到平衡后,移走体系中部分C(s),平衡___,将产生的CO全部移走,平衡___(以上两空选填“向左移”、“向右移”、“不移动”).
④上述反应在t0时刻达到平衡(如图2),若在t1时刻改变某一条件,请在图2中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①增大容器体积(用实线表示) ②升高温度(用虚线表示)
▼优质解答
答案和解析
(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1.
(3)①C (s)+H2O(g)⇌CO (g)+H2 (g)的平衡常数K=
; 向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),设H2O(g)的变化量为xmol,则
C (s)+H2O(g)⇌CO (g)+H2 (g)
起始物质的量(mol) 1 0 0
变化物质的量(mol) x x x
起始物质的量(mol) 1-x x x
K=c(CO)•c(H2)/c(H2O)=x•x/(1-x)=0.5,解得x=0.5,则H2O(g)的转化率为
=50%,
故答案为:50%;
②a.升高温度反应速率增大且平衡正向移动,可以提高平衡体系中H2的百分含量,故a正确;
b.增大水蒸气的浓度,反应速率增大,生成H2的量增大,但可以平衡体系中H2的百分含量降低,故b错误;
c.加入催化剂反应速率增大,平衡不移动,故c错误;
d.降低压强,平衡正向移动,可以提高平衡体系中H2的百分含量,但反应速率降低,故d错误;故答案为:a;
③改变碳的量,不影响反应速率,不影响平衡的移动;将产生的CO全部移走,平衡右移.
故答案为:不移动;向右移;
④①增大容器体积,浓度减小,正反应速率立即减小;而增大容器体积后平衡右移,反应物浓度继续减小,故正反应速率在立即减小后会继续逐渐减小,故图象为: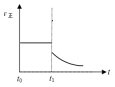 ,故答案为:
,故答案为: ;
;
②升高温度,反应速率加快;而升高温度后平衡右移,反应物浓度继续减小,故正反应速率在立即增大后会逐渐减小,故图象为: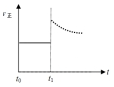 ,故答案为:
,故答案为: .
.
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1.
(3)①C (s)+H2O(g)⇌CO (g)+H2 (g)的平衡常数K=
| c(CO)•c(H2) |
| c(H2O) |
C (s)+H2O(g)⇌CO (g)+H2 (g)
起始物质的量(mol) 1 0 0
变化物质的量(mol) x x x
起始物质的量(mol) 1-x x x
K=c(CO)•c(H2)/c(H2O)=x•x/(1-x)=0.5,解得x=0.5,则H2O(g)的转化率为
| 0.5mol |
| 1mol |
故答案为:50%;
②a.升高温度反应速率增大且平衡正向移动,可以提高平衡体系中H2的百分含量,故a正确;
b.增大水蒸气的浓度,反应速率增大,生成H2的量增大,但可以平衡体系中H2的百分含量降低,故b错误;
c.加入催化剂反应速率增大,平衡不移动,故c错误;
d.降低压强,平衡正向移动,可以提高平衡体系中H2的百分含量,但反应速率降低,故d错误;故答案为:a;
③改变碳的量,不影响反应速率,不影响平衡的移动;将产生的CO全部移走,平衡右移.
故答案为:不移动;向右移;
④①增大容器体积,浓度减小,正反应速率立即减小;而增大容器体积后平衡右移,反应物浓度继续减小,故正反应速率在立即减小后会继续逐渐减小,故图象为:
 ,故答案为:
,故答案为: ;
;②升高温度,反应速率加快;而升高温度后平衡右移,反应物浓度继续减小,故正反应速率在立即增大后会逐渐减小,故图象为:
 ,故答案为:
,故答案为: .
.
看了 根据下列叙述写出相应的热化学...的网友还看了以下:
2m-1)x平方+2(m+1)x+4是完全平方式,求m的值 已知k为非负数,请确认一下方程x²-( 2020-05-16 …
如果2n+1是一个完全平方数,3n+1也是个完全平方数,那么5n+1可不可以是一个质数?完全平方数 2020-05-17 …
《应用写作》第04章在线测试第二题、多项选择题1、叙述的要求有()A、人称明确B、叙述准确C、头绪 2020-06-03 …
1.若x是非零自然数,y=x^4+2x^3+2x^2+2x+1,则()A.y一定是完全平方数B.y 2020-06-07 …
《伤仲永》1.方仲永由神童沦为平庸之辈的原因是什么?文章讲了一个什么道理?2.文第一自然段叙事有几 2020-06-19 …
下列有关日本人文环境的叙述,错误的是()A.日本人口有1.27亿,地狭人稠B.由于受西方影响大,人 2020-06-19 …
语文题,求解答1.狼牙山五壮士这篇课文是按照事情发展的顺序记叙的.全文记叙的顺序是:接受任务→诱语 2020-06-27 …
配成完全平方的形式,如把3+2根号2配成完全平方公式的形式:3+2根号2=(根号2)的平方+2×根 2020-06-27 …
课本指出:公认的真命题称为公理,除了公理外,其他的真命题(如推论、定理等)的正确性都需要通过推理的 2020-07-15 …
1.已知X=100...00(N个0)100000...00(N+1个0)50则()A.X是完全平 2020-07-16 …