早教吧作业答案频道 -->化学-->
氮及氮的化合物在化工研究中是一门重要的课题.I.某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔
题目详情
氮及氮的化合物在化工研究中是一门重要的课题.
I.某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔绝空气加热可得到12.8gB和气体单质C.请回答:
(1)写出SCl2与氨反应的化学方程式___.
II.已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
(2)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),简述该设想能否实现的依据:___.
(3)汽车尾气转化器中发生的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=___.
(4)有容积相同的甲、乙两个密闭容器,甲充入等量的NO和CO气体,乙充入NO气体.
以Ag-ZSM-5为催化剂,分别在不同温度下同时发生反应,测得相同时间内NO的转化率,绘得图象如图1.
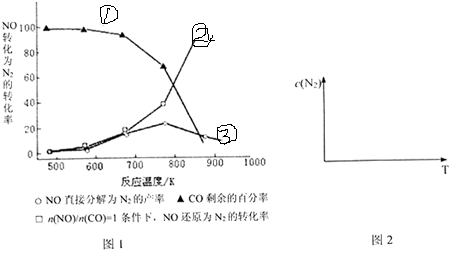 分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
(5)已知常温下HNO2的电离常数K=4.6×10-4,求0.01mol•L-1的HNO2溶液中c(H+)=___mol•L-1.(
=2.14)
I.某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔绝空气加热可得到12.8gB和气体单质C.请回答:
(1)写出SCl2与氨反应的化学方程式___.
II.已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
(2)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),简述该设想能否实现的依据:___.
(3)汽车尾气转化器中发生的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=___.
(4)有容积相同的甲、乙两个密闭容器,甲充入等量的NO和CO气体,乙充入NO气体.
以Ag-ZSM-5为催化剂,分别在不同温度下同时发生反应,测得相同时间内NO的转化率,绘得图象如图1.
 分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.(5)已知常温下HNO2的电离常数K=4.6×10-4,求0.01mol•L-1的HNO2溶液中c(H+)=___mol•L-1.(
| | 4.6 |
▼优质解答
答案和解析
(1)因为“SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7、A隔绝空气加强热可得到 B和气体单质C”知B是S,A含N、S元素,C是氮气,X是氯化铵.n(A)=
=0.1mol,n(S)=
=0.4mol,则A中含N:
=0.4mol,故A的分子式为S4N4,所以SCl2与氨反应生成A和淡黄色单质B及离子化合物X,反应方程式:6SCl2+16NH3=S4N4+2S+12NH4Cl,
故答案为:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(2)因为C不完全燃烧时产生CO为放热反应,则2CO(g)=2C(s)+O2(g)△H>0,又熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;故答案为:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
(3)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律③×2-①-②得2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-393.5×2-180.5+221.0=-746.5kJ•mol-1,故答案为:-746.5kJ•mol-1;
(4)根据(3)2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以NO的转化率应该减小,而曲线②NO转化率随温度升高而增大说明反应没有达到平衡,温度越高反应速率越快,转化率越大;
又2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以温度越高,平衡时c(N2)越小,则变化趋势图为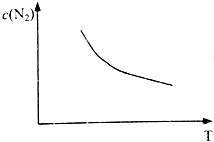 ,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大;
,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大; .
.
(5)因为HNO2的电离方程式为HNO2⇌H++NO2-,又电离常数K=4.6×10-4,所以K=
=
=4.6×10-4,解得:c(H+)=2.14×10-3mol•L-1,故答案为:2.14×10-3.
| 18.4g |
| 184g/mol |
| 12.8g |
| 32g/mol |
| (18.4-0.4×32)g |
| 14g/mol |
故答案为:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(2)因为C不完全燃烧时产生CO为放热反应,则2CO(g)=2C(s)+O2(g)△H>0,又熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;故答案为:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
(3)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律③×2-①-②得2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-393.5×2-180.5+221.0=-746.5kJ•mol-1,故答案为:-746.5kJ•mol-1;
(4)根据(3)2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以NO的转化率应该减小,而曲线②NO转化率随温度升高而增大说明反应没有达到平衡,温度越高反应速率越快,转化率越大;
又2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以温度越高,平衡时c(N2)越小,则变化趋势图为
 ,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大;
,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大; .
.(5)因为HNO2的电离方程式为HNO2⇌H++NO2-,又电离常数K=4.6×10-4,所以K=
| c(H +)c(NO 2 -) |
| c(HNO 2) |
| c 2(H +) |
| 0.01mol/L |
看了 氮及氮的化合物在化工研究中是...的网友还看了以下:
根据所给图A~E回答问题。(1)图A所示全过程叫,图B生理过程与图一中相对应序号是,图C生理过程与 2020-05-02 …
问道物理题(选自2010河北会考卷)红光,绿光,黄光以相同的入射角从水中射向空气,若黄光刚好发生全 2020-05-12 …
有100道题让3名学生做,每人做了60题,这时100题已全解,问这100题中难题多还是易题多,多多 2020-06-17 …
根据图示回答下列问题:(1)图A所示全过程叫,图B生理过程与图A中相对应的序号是,图C生理过程与图 2020-06-19 …
多选题发展心理学研究的主要内容包括()。(A)一生全过程心理发展年龄阶段特征(B)阐明各种心理机能 2020-07-13 …
有100位学生回答A.B两题,有75人答对A题,有83人答对B题,有68人两道题全答对,问A.B两 2020-07-17 …
2017年3月27日是第22个“全国中小学生安全教育日”,2017年的主题是()A.“我安全、我健康 2020-11-04 …
近日我市各中小学校开展了主题安全教育活动。全市中小学生体验了火灾现场逃生演练,踩踏事故应急避险等安全 2020-11-22 …
关注民生问题,是每年全国人民代表大会和政治协商会议的重要议题。近代史上,提出资产阶级“民生主义”理想 2020-11-22 …
大气中二氧化碳含量增多导致全球气候变化,已成为全球关注的热点问题.图为地球热量平衡示意图.读图回答2 2020-12-14 …