早教吧作业答案频道 -->化学-->
为实现低碳低能耗,需要对含碳相关物质进行研究.(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1②H2(g)+CO(g)⇌CH3OH(1)△H2=-128.3kJ•mol-1③2H2(g)+O2(g)⇌2H2O(g)
题目详情
为实现低碳低能耗,需要对含碳相关物质进行研究.
(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②H2(g)+CO(g)⇌CH3OH(1)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O(g)△H3=-483.6kJ•mol-1
采用甲烷和氧气一步合成液态甲醇的热化学方程式为___.
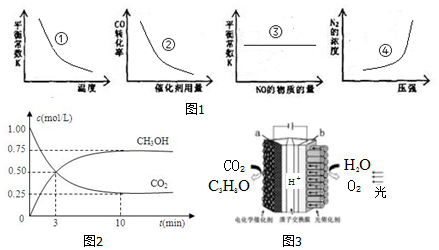
(2)治理汽车尾气的反应是2NO(g)+2CO(g)⇌2CO2(g)+N2(g),△H<0.反应达平衡后,改变一个条件,下列①到④的图象不正确的是___.
(3)反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol.在体积为1L的恒容密闭容器甲中,充入1mol CO2和4mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①该反应的平衡常数表达式为___.
②从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min).
③若在起始体积为1L的恒压密闭容器乙中,充入1mol CO2和4mol H2,相同条件下发生反应,当达到平衡后,c(CO2甲)___c(CO2乙)(填>、<、=)
(4)某模拟“人工树叶”电化学实验装置如图3所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).该装置能量转化关系为___.a极的电极反应式为___.
(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②H2(g)+CO(g)⇌CH3OH(1)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O(g)△H3=-483.6kJ•mol-1
采用甲烷和氧气一步合成液态甲醇的热化学方程式为___.
(2)治理汽车尾气的反应是2NO(g)+2CO(g)⇌2CO2(g)+N2(g),△H<0.反应达平衡后,改变一个条件,下列①到④的图象不正确的是___.
(3)反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol.在体积为1L的恒容密闭容器甲中,充入1mol CO2和4mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图2所示.

①该反应的平衡常数表达式为___.
②从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min).
③若在起始体积为1L的恒压密闭容器乙中,充入1mol CO2和4mol H2,相同条件下发生反应,当达到平衡后,c(CO2甲)___c(CO2乙)(填>、<、=)
(4)某模拟“人工树叶”电化学实验装置如图3所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).该装置能量转化关系为___.a极的电极反应式为___.
▼优质解答
答案和解析
(1)由①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)⇌CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O (g)△H3=-483.6kJ•mol-1
根据盖斯定律:①+②+
×③得CH4(g)+
O2 (g)⇌CH3OH(l)△H1=-164.0kJ•mol-1.
故答案为:CH4(g)+
O2 (g)⇌CH3OH(l)△H1=-164.0kJ•mol-1;
(2)2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0.
①平衡常数与温度有关,反应为放热反应,升温平衡逆向进行平衡常数减小,图象可知曲线变化正确,故①正确;
②催化剂改变化学反应速率不改变化学平衡,反应物转化率不变,故②错误;
③平衡常数与温度有关,温度不变,则平衡常数始终不变,改变NO物质的量是改变浓度不改变平衡常数,图象变化正确,故③正确;
④反应正反应为气体体积减小的反应,压强增大平衡正向进行氮气浓度增大,故④正确;
故答案为:②;
(3)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,表达式K=
,
故答案为:
;
②利用三段式解题法计算
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=0.225 mol•L-1•min-1,
故答案为:0.225;
③若在起始体积为1L的恒压密闭容器乙中,充入1mol CO2和4mol H2,为保持恒压体积增大,最后达到平衡状态,和恒温恒容容器中.充入1mol CO2和4mol H2相比,反应正向进行气体体积减小,相当于减小体积压强增大,平衡正向进行,二氧化碳浓度c(CO2甲)<c(CO2乙 ),
故答案为:<;
(4)根据图知,该装置有外接电源,属于电解池,该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,电解时a是阴极、b是阳极,a电极上CO2得电子生成C3H8O,阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-=O2↑+4H+,a为阳极,阳极上CO2得电子生成C3H8O,电极反应式为3CO2+18H++18e-=C3H8O+5H2O,
故答案为:电能和光能转化为化学能;3CO2+18H++18e‒=C3H8O+5H2O.
②2H2(g)+CO(g)⇌CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)⇌2H2O (g)△H3=-483.6kJ•mol-1
根据盖斯定律:①+②+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:CH4(g)+
| 1 |
| 2 |
(2)2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0.
①平衡常数与温度有关,反应为放热反应,升温平衡逆向进行平衡常数减小,图象可知曲线变化正确,故①正确;
②催化剂改变化学反应速率不改变化学平衡,反应物转化率不变,故②错误;
③平衡常数与温度有关,温度不变,则平衡常数始终不变,改变NO物质的量是改变浓度不改变平衡常数,图象变化正确,故③正确;
④反应正反应为气体体积减小的反应,压强增大平衡正向进行氮气浓度增大,故④正确;
故答案为:②;
(3)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,表达式K=
| c(CH3OH)c(H2O) |
| c(CO2)c2(H2) |
故答案为:
| c(CH3OH)c(H2O) |
| c(CO2)c2(H2) |
②利用三段式解题法计算
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
故答案为:0.225;
③若在起始体积为1L的恒压密闭容器乙中,充入1mol CO2和4mol H2,为保持恒压体积增大,最后达到平衡状态,和恒温恒容容器中.充入1mol CO2和4mol H2相比,反应正向进行气体体积减小,相当于减小体积压强增大,平衡正向进行,二氧化碳浓度c(CO2甲)<c(CO2乙 ),
故答案为:<;
(4)根据图知,该装置有外接电源,属于电解池,该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,电解时a是阴极、b是阳极,a电极上CO2得电子生成C3H8O,阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-=O2↑+4H+,a为阳极,阳极上CO2得电子生成C3H8O,电极反应式为3CO2+18H++18e-=C3H8O+5H2O,
故答案为:电能和光能转化为化学能;3CO2+18H++18e‒=C3H8O+5H2O.
看了 为实现低碳低能耗,需要对含碳...的网友还看了以下:
求证o(g(x))+-o(g(x))=o(g(x))(x趋于x0) 2020-05-17 …
∵EM是⊙O的切线,怎么推出EB•EC=EM2①?,看题后回答.(2005•温州)如图,已知四边形 2020-05-21 …
同阶无穷小量的表示方法?急!还有f(x)=O(g(x))是什么意思?老师说f(x)=h(x)g(x 2020-06-05 …
谁帮我做下下面的关于时间复杂度的习题?f(n)=100n^3+n^2+1000,g(n)=25n^ 2020-06-12 …
判断下列各组单词括号内部分发音是否相同.h(o)td(o)g()cl(o)ckc(o)ffee() 2020-06-26 …
已知H2(g)+12O2(g)=H2O(l);△H=─285.8KJ/moL可通过两种途径来完成分 2020-07-19 …
请写出下列反应平衡常数K的表达式CH四(g)+2O二(g)=CO二(g)+2H二O(g)AL二O三 2020-07-29 …
一个有关大O(阶)的问题求两个单调递增函数f(n)和g(n)(n为自然数),f(n)≠O(g(n) 2020-07-31 …
设f(N)、g(N)是定义在正数集上的正函数.如果存在正的常数C和自然数N0,使得当N≥N0时有f 2020-07-31 …
大气臭氧层的反应是:O+O3=2O2△H,该反应的能量变化如图所示,下列叙述中,正确的是()A.O+ 2020-10-31 …