早教吧作业答案频道 -->化学-->
工业上合成尿素(H2NCONH2)分为两步:第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);第二步,将氨基甲酸铵分解得到尿素:H2NCOONH4(l)⇌H2O(1)+H2NCONH2(1)△H1═+226.3kJ•
题目详情
工业上合成尿素(H2NCONH2)分为两步:
第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)⇌H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)⇌H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是___.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式___.
(2)已知:NH2COONH4(s)⇌2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
①下列能判断该反应达到平衡的是___
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是___.
③上表实验的目的是___,通过数据分析得出的结论是___.
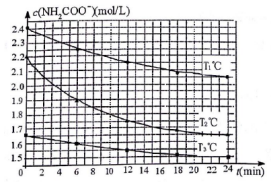
(3)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率___ (保留2位有效数字).
②比较图中T1、T2的大小:T1___T2(填“>”、“=”或“<”),判断的理由是___.
第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)⇌H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.

(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)⇌H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是___.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式___.
(2)已知:NH2COONH4(s)⇌2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是___.
③上表实验的目的是___,通过数据分析得出的结论是___.
(3)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率___ (保留2位有效数字).
②比较图中T1、T2的大小:T1___T2(填“>”、“=”或“<”),判断的理由是___.
▼优质解答
答案和解析
(1)①2NH3(l)+CO2(g)⇌H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1,反应为气体体积减小的放热反应,提高尿素产率平衡正向进行,
A.升温平衡逆向进行,尿素产率减小,故A错误;
B.加压平衡正向进行,尿素产率增大,故B正确;
C.添加催化剂改变反应速率,不改变化学平衡,产率不变,故C错误;
故答案为:B;
②Ⅰ.H2NCOONH4(l)⇌H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1,
Ⅱ.2NH3(l)+CO2(g)⇌H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1,
盖斯定律计算Ⅱ-Ⅰ得到:2NH3(l)+CO2(g)⇌H2NCOONH4(l)△H=-330.0kJ•mol-1,
故答案为:2NH3(l)+CO2(g)⇌H2NCOONH4(l)△H=-330.0kJ•mol-1;
(2)①NH2COONH4(s)⇌2NH3(g)+CO2(g),反应为气体体积增大的反应,
A、2v正(NH3)═v逆(CO2) 未体现正逆的关系,v正(NH3)═2v逆(CO2)体现了正逆反应速率相同,故A错误;
B、因为反应物是固体,容器中氨气和二氧化碳的物质的量之比为2:1,密闭容器中氨气的体积分数不变,故B错误;
C、密闭容器中气体总浓度不变,说明总物质的量不变,正逆反应速率相等,故C正确;
D、因为反应物是固体,所以整个体系中气体摩尔质量是个定值,故D错误;
故答案为;C;
②25.0℃,总浓度为4.8×10-3 mol/L,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3 mol/L、1.6×10-3 mol/L,代入平衡常数表达式:K=(3.2×10-3)2×1.6×10-3 =1.6384×10-10,
15.0℃时,总浓度为2.4×10-3 mol/L,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为1.6×10-3 mol/L、0.8×10-3 mol/L,代入平衡常数表达式:K=(1.6×10-3)2×0.8×10-3 =2.048×10-9,25.0℃与15.0℃时的平衡常数之比=1.6384×10-10:2.048×10-9=8,
故答案为:8;
(3)T3℃时,0~12min氨基甲酸铵水解反应的平均速率,依据图象可知浓度变化c(NH2COO-)=1.65mol/L-1.1.55mol/L=0.1mol/L,化学反应速率V=
=0.0083mol/(L•min),
故答案为:0.0083mol/(L•min);
⑤因T2℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比T1℃大,说明T1<T2,T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大,
故答案为:<;T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
A.升温平衡逆向进行,尿素产率减小,故A错误;
B.加压平衡正向进行,尿素产率增大,故B正确;
C.添加催化剂改变反应速率,不改变化学平衡,产率不变,故C错误;
故答案为:B;
②Ⅰ.H2NCOONH4(l)⇌H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1,
Ⅱ.2NH3(l)+CO2(g)⇌H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1,
盖斯定律计算Ⅱ-Ⅰ得到:2NH3(l)+CO2(g)⇌H2NCOONH4(l)△H=-330.0kJ•mol-1,
故答案为:2NH3(l)+CO2(g)⇌H2NCOONH4(l)△H=-330.0kJ•mol-1;
(2)①NH2COONH4(s)⇌2NH3(g)+CO2(g),反应为气体体积增大的反应,
A、2v正(NH3)═v逆(CO2) 未体现正逆的关系,v正(NH3)═2v逆(CO2)体现了正逆反应速率相同,故A错误;
B、因为反应物是固体,容器中氨气和二氧化碳的物质的量之比为2:1,密闭容器中氨气的体积分数不变,故B错误;
C、密闭容器中气体总浓度不变,说明总物质的量不变,正逆反应速率相等,故C正确;
D、因为反应物是固体,所以整个体系中气体摩尔质量是个定值,故D错误;
故答案为;C;
②25.0℃,总浓度为4.8×10-3 mol/L,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3 mol/L、1.6×10-3 mol/L,代入平衡常数表达式:K=(3.2×10-3)2×1.6×10-3 =1.6384×10-10,
15.0℃时,总浓度为2.4×10-3 mol/L,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为1.6×10-3 mol/L、0.8×10-3 mol/L,代入平衡常数表达式:K=(1.6×10-3)2×0.8×10-3 =2.048×10-9,25.0℃与15.0℃时的平衡常数之比=1.6384×10-10:2.048×10-9=8,
故答案为:8;
(3)T3℃时,0~12min氨基甲酸铵水解反应的平均速率,依据图象可知浓度变化c(NH2COO-)=1.65mol/L-1.1.55mol/L=0.1mol/L,化学反应速率V=
| 0.1mol/L |
| 12min |
故答案为:0.0083mol/(L•min);
⑤因T2℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比T1℃大,说明T1<T2,T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大,
故答案为:<;T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
看了 工业上合成尿素(H2NCON...的网友还看了以下:
Matlab求帮忙看看哪里错了.h=0;%h[0,51.5]a=15;m=sMatlab求帮忙看看 2020-05-13 …
抽象代数问:H、K是G的子群如果HK=KH,H∩K={1},证明HK同构于H×K(H和K不一定正规 2020-07-09 …
C关于自加结果#includevoidmain(){intj=5,k=5,h=5,q,r,s;q= 2020-07-23 …
要清楚过程(但愿这道题没有毛病)设k是三次多项式f(x)=x^3-3x+10的一个根(这是什么意思 2020-08-03 …
下列说法正确的是()A.CO2溶于水能导电,因此CO2是电解质B.KHSO4只有在电流作用下才能电离 2020-11-16 …
关于生物体内氨基酸的叙述正确的是()A.组成人体的氨基酸都能在人体内合成B.氨基酸是蛋白质分子的单体 2020-12-28 …
1.以L,C,K开头的英文单词组成的句子2.以C,H,F开头的英文单词组成的句子3.以L,C,K,C 2021-02-05 …
a.NACL固体,b.石墨,c.蔗糖,d.二氧化碳,e.Cu,f.BaSO4,g.氨水,h.KOH溶 2021-02-05 …
把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联氨(N 2021-02-08 …
(1)把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到联 2021-02-08 …