已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/molNa2O2(s)+CO2(g)═Na2CO3(s)+12O2(g)△H=-226kJ/mol根据以上热化学方程式判断,下列说法正确的是()A.CO的燃烧热为566kJ/molB.如图可表示由CO
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+
O2(g)△H=-226kJ/mol1 2
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为566 kJ/mol
B. 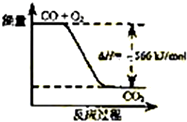
如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol
D. CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA
B、2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,表示2mol的一氧化碳完全反应生成2mol的二氧化碳放出热量,则生成物能量比反应物能量低,故B正确;
C、题目中第二个方程的2倍为:2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,本题中的CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452,但是△H>-452 kJ/mol,故C错误;
D、反应Na2O2(s)+CO2(g)═Na2CO3(s)+
| 1 |
| 2 |
故选B.
有一列数a1=1,以后各项a2,a3,a4…法则如下: 如果an-2为自然数且前面未写出过,则写 2020-05-16 …
1.如果n阶行列式中负项的个数为偶数,则n>= 2.如果n阶行列式中等于零的元素个数大于n^2-n 2020-05-16 …
初中数学的提公因式法中的一个疑问?比如(X-2)^2可以和 X^2-4X+4相互转化,那(X-2) 2020-05-17 …
如果ax+b=0,其中a,b为有理数,x为无理数,那么a=0且b=0.(1)如果(a-2)2+b+ 2020-06-14 …
1.小明的体重约为51.51kg,如果精确到10kg,其结果为kg;如果精确到1kg.其结果为;如 2020-07-17 …
如图,在平面直角坐标系中,O为坐标原点,圆C的圆心坐标为(-2,-2)如图,在平面直角坐标系中,O 2020-07-26 …
在△ABC中,BD为∠ABC的平分线.(1)如图1,∠C=2∠DBC,∠A=60°,请判断△ABC的 2020-11-02 …
质能关系究竟粒子的动能,能量,动量如何算的呢?为什么有时不用定义式(如Ek=1/2mv^2),如光子 2020-11-25 …
如图为一正在测量中的多用电表表盘.(1)如图甲,如果用直流50V档测量电压,则读数为V.如果用直流2 2020-11-29 …
1.如果二次项数x^2-ax-8(a为整数)在整数范围内用因式分解,求a的值2.如果2^8+2^10 2020-12-26 …