早教吧作业答案频道 -->化学-->
目前,CO、CO2的有效开发利用成为科学家研究的重要课题.Ⅰ.CO可用于合成甲醇(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)⇌CH3O
题目详情
目前,CO、CO2的有效开发利用成为科学家研究的重要课题.
Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)⇌CH3OH(g)的△H=___.
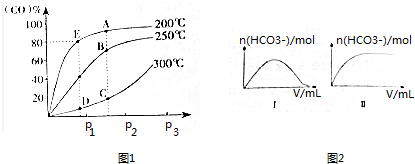
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)___ω(B)(填“>”、“<”或“=”),理由为___.
②C、D两点的逆反应速率:v正(C)___v逆(D)(填“>”、“<”或“=”),理由为___.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=___;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为___.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使
增大的是___(填选项字母).
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:①NaHC2O4②HNO3③HClO,溶液中的n(HCO3-)与所加入溶液体积(V)的关系如图2所示.其中,符合曲线Ⅰ的溶液为___(填序号,下同);符合曲线Ⅱ的溶液为___.

Ⅰ.CO可用于合成甲醇
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为-283kJ•mol-1、-285.8kJ•mol-1、-764.5kJ•mol-1,则CO(g)+2H2(g)⇌CH3OH(g)的△H=___.
(2)将1molCO和2molH2充入密闭容器中发生上述反应.气体条件相同时,CO的平衡转化率[α(CO)]与压强(p)和温度(T)的关系如图1所示.
①A、B两点CH3OH的质量分数ω(A)___ω(B)(填“>”、“<”或“=”),理由为___.
②C、D两点的逆反应速率:v正(C)___v逆(D)(填“>”、“<”或“=”),理由为___.
③200℃时,测得E的容器容积为10L.该温度下,反应的平衡常数K=___;保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为___.
Ⅱ.CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景.T℃时,在容积为1L的恒容密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0,其它条件不变,下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g) C.加入催化剂 D.再充入一定量CO2
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
已知:25℃时,几种酸的电离平衡常数如下表所示.
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
▼优质解答
答案和解析
I.(1)由CO、H2、CH3OH(g)的燃烧热可得热化学方程式:
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②H2(g)+
O2(g)=H2O(l)△H=-285.8kJ•mol-1
③CH3OH(g)+
O2(g)=CO2(g)+2 H2O(l)△H=-764.5kJ•mol-1
由盖斯定律可知,①+2×②-③可得CO(g)+2H2(g)⇌CH3OH(g),故△H=-283.0kJ•mol-1+2×(-285.8kJ•mol-1 )-(-764.5kJ•mol-1 )=-90.1kJ•mol-1,
故答案为:-90.1kJ•mol-1;
(2)①A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动,故CH3OH的质量分数ω(A)>ω(B),
故答案为:>;A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动;
②该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快,逆反应速率:v正(C)>v逆(D),
故答案为:>;该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快;
③E点CO转化率为80%,转化的CO为0.8mol,则:
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol):1 2 0
变化量(mol):0.8 1.6 0.8
平衡量(mol):0.2 0.4 0.8
容器体积为10L,则平衡常数K=
=
=2500,
保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,反应正向进行,则浓度商Qc=
<2500,解得x<58,故0<x<58
故答案为:2500;0<x<58;
Ⅱ.(3)A.正反应为放热反应,升高温度,平衡逆向移动,
减小,故A错误;
B.再充入1molCH3OH(g)和1molH2O(g),等效为在原平衡基础上增大压强,平衡正向移动,
增大,故B正确;
C.加入催化剂可以加快反应速率,不影响平衡移动,
不变,故C错误;
D.
=K×
,再充入一定量CO2,平衡正向移动,氢气浓度减小、水蒸气浓度增大,
减小,故D错误,
故选:B;
(4)由电离平衡常数可知,酸性:H
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH3OH(g)+
| 3 |
| 2 |
由盖斯定律可知,①+2×②-③可得CO(g)+2H2(g)⇌CH3OH(g),故△H=-283.0kJ•mol-1+2×(-285.8kJ•mol-1 )-(-764.5kJ•mol-1 )=-90.1kJ•mol-1,
故答案为:-90.1kJ•mol-1;
(2)①A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动,故CH3OH的质量分数ω(A)>ω(B),
故答案为:>;A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动;
②该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快,逆反应速率:v正(C)>v逆(D),
故答案为:>;该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快;
③E点CO转化率为80%,转化的CO为0.8mol,则:
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol):1 2 0
变化量(mol):0.8 1.6 0.8
平衡量(mol):0.2 0.4 0.8
容器体积为10L,则平衡常数K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| ||||
|
保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,反应正向进行,则浓度商Qc=
| ||||
|
故答案为:2500;0<x<58;
Ⅱ.(3)A.正反应为放热反应,升高温度,平衡逆向移动,
| n(CH3OH) |
| n(CO2) |
B.再充入1molCH3OH(g)和1molH2O(g),等效为在原平衡基础上增大压强,平衡正向移动,
| n(CH3OH) |
| n(CO2) |
C.加入催化剂可以加快反应速率,不影响平衡移动,
| n(CH3OH) |
| n(CO2) |
D.
| n(CH3OH) |
| n(CO2) |
| c3(H2) |
| c(H2O) |
| n(CH3OH) |
| n(CO2) |
故选:B;
(4)由电离平衡常数可知,酸性:H
作业帮用户
2017-11-02
看了 目前,CO、CO2的有效开发...的网友还看了以下:
用所给字母拼成单词.1.a,l,a,d,s.2.a,d,o,s.3.c,o,r,p,n用所给字母拼 2020-05-15 …
已知圆O方程为x^2+(y-1)^2=5,直线L方程Mx-y+1-M=0(1)求证当M∈R时,L与 2020-05-23 …
重新排列字母,写出单词1.s,a,p,e,c,2.r,o,e,t,c,k,3.d,c,o,o,t, 2020-06-06 …
对英语单词熟练的人来!c,o,l,t,e,s()g,g,p,a,n,e,t,l,()gosomew 2020-06-07 …
如图,已知点A,B在半径为1的O上,∠AOB=60°,延长OB至C,过点C作直线OA的垂线记为l, 2020-06-12 …
如果向量a=(1,0,1),b=(O,1,1)分别平行于平面c与d,且都与这两个平面的交线L垂直, 2020-06-27 …
这个通达信指标是什么意思内外盘差}PJ:=(H+L+C)/3;V1:=IF(H=L,1,H-MAX 2020-07-09 …
已知⊙O的半径r=5,O到直线L的距离OA=3,点B、C、D在直线L上,且AB=2,AC=4,AD 2020-07-30 …
刚才你帮我写的这句公式有错误哦!(H-MAX(C,O))>(MIN(C,O)-L)or((H-MAX 2020-11-04 …
英语:下1.将下联打乱的字母组成单词,并写出汉语意思1.a,e,h,g,c,n[]2.e,i,s,t 2020-12-10 …