早教吧作业答案频道 -->化学-->
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.Ⅰ.已知:CO的燃烧热为283KJ•mol-1,2Fe(s)+32O2(g
题目详情
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
Ⅰ.已知:CO的燃烧热为283KJ•mol-1,2Fe(s)+
O2(g)=Fe2O3(s)△H=-825.5KJ•mol-1.
(1)反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=___KJ•mol-1
Ⅱ.反应
Fe2O3(s)+CO(g)═
Fe(s)+CO2(g)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡CO的平衡转化率为60%.
(2)在1000℃的平衡常数等于___.
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是___.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
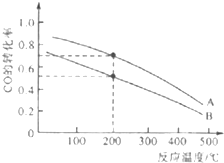
Ⅲ.高炉炼铁产生的废气中CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)═CH3OH(g).请根据图示回答下列问题:
(4)图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强为5.0MPa的曲线是___(填“A”或“B”)
(5)该反应在进行的过程中,v正(H2)___v逆(CO)+v正(CH2OH)(填“>”“<”或“=”)
(6)在不改变反应混合物用量的前提下,为了加快反应速率且提高CO的转化率,可采取的最佳措施是___.
(7)甲醇可与氯气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式:___.
Ⅰ.已知:CO的燃烧热为283KJ•mol-1,2Fe(s)+
| 3 |
| 2 |

(1)反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=___KJ•mol-1
Ⅱ.反应
| 1 |
| 3 |
| 2 |
| 3 |
(2)在1000℃的平衡常数等于___.
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是___.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
Ⅲ.高炉炼铁产生的废气中CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)═CH3OH(g).请根据图示回答下列问题:
(4)图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强为5.0MPa的曲线是___(填“A”或“B”)
(5)该反应在进行的过程中,v正(H2)___v逆(CO)+v正(CH2OH)(填“>”“<”或“=”)
(6)在不改变反应混合物用量的前提下,为了加快反应速率且提高CO的转化率,可采取的最佳措施是___.
(7)甲醇可与氯气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式:___.
▼优质解答
答案和解析
(1)已知:①CO(g)+
O2(g)═CO2(g)△H2=-283kJ/mol,②2Fe(s)+
O2(g)=Fe2O3(s)△H=-825.5KJ•mol-1,①×3-②得到反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),该反应的△H=(-283kJ/mol)×3-(-825.5KJ•mol-1)=-23.5kJ/mol,
故答案为:-23.5kJ/mol;
(2)反应
Fe2O3(s)+CO(g)=Fe2O3(s)+CO2(g)的平衡常数K=
,
Fe2O3(s)+CO(g)=Fe2O3(s)+CO2(g)
初始浓度:0.1 0.1
变化浓度:0.06 0.18
平衡浓度:0.04 0.28
K=
=7,
故答案为:7;
(3)a、该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故A错误;
b、增加压强,平衡逆向移动,CO的平衡转化率减小,故b错误;
c、选取合适的催化剂,不影响平衡移动,CO的平衡转化率不变,故c错误;
d、及时吸收或移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
故选d.
(4)比较压强,统一温度,在相同温度200℃时,A的转化率比B的高,说明压强改变,平衡正向移动,对于CO(g)+2H2(g)⇌CH3OH(g),是气体体积缩小的反应,则压强的改变只能是增大压强,所以A点的压强大,为5.0MPa,
故答案为:A;
(5)反应速率之比等于各物质计量数之比,达平衡时,v逆(CO)=v正(CH3OH)=
v正(H2),即v正(H2)=v逆(CO)+v正(CH3OH),在达平衡之前,正反应速率大于逆反应速率,即v正(CH3OH)>v逆(CO),故达平衡前v正(H2)>v逆(CO)+v正(CH3OH),
故答案为:>;
(6)不改变反应混合物用量的前提下,用温度、压强对化学平衡产生影响,从图中可知,升温CO的转化率降低,降温速率会减慢,所以选择增大压强,加快反应速率且平衡正向移动,提高CO的转化率,
故答案为:其他条件不变,增大压强;
(7)燃料电池的负极通入燃料,失去电子发生氧化反应,在碱性环境的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:-23.5kJ/mol;
(2)反应
| 1 |
| 3 |
| c(CO2) |
| c(CO) |
| 1 |
| 3 |
初始浓度:0.1 0.1
变化浓度:0.06 0.18
平衡浓度:0.04 0.28
K=
| 0.28 |
| 0.04 |
故答案为:7;
(3)a、该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故A错误;
b、增加压强,平衡逆向移动,CO的平衡转化率减小,故b错误;
c、选取合适的催化剂,不影响平衡移动,CO的平衡转化率不变,故c错误;
d、及时吸收或移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
故选d.
(4)比较压强,统一温度,在相同温度200℃时,A的转化率比B的高,说明压强改变,平衡正向移动,对于CO(g)+2H2(g)⇌CH3OH(g),是气体体积缩小的反应,则压强的改变只能是增大压强,所以A点的压强大,为5.0MPa,
故答案为:A;
(5)反应速率之比等于各物质计量数之比,达平衡时,v逆(CO)=v正(CH3OH)=
| 1 |
| 2 |
故答案为:>;
(6)不改变反应混合物用量的前提下,用温度、压强对化学平衡产生影响,从图中可知,升温CO的转化率降低,降温速率会减慢,所以选择增大压强,加快反应速率且平衡正向移动,提高CO的转化率,
故答案为:其他条件不变,增大压强;
(7)燃料电池的负极通入燃料,失去电子发生氧化反应,在碱性环境的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
看了 钢铁工业是国民经济的重要基础...的网友还看了以下:
19世纪70年代,欧美主要资本主义国家普遍确立了资产阶级代议制,其中德国的政体是A.联邦制B.君主 2020-05-13 …
材料郑和是我国也是世界历史上的伟大航海家。1405-1433年,郑和奉明成祖朱棣之命,七次远涉重洋 2020-06-27 …
下列各句中,没有语病的一项是[]A.可惜,这部在他心中酝酿了很久、即将成熟的巨著未及完稿,就过早地 2020-07-06 …
下列对西方国家推行福利制度的说法中,不正确的是:A.二战后西欧资本主义国家普遍实行B.实现了社会平 2020-07-28 …
中外历史人物评说材料郑和是我国也是世界历史上的伟大航海家.1405-1433年,郑和奉明成祖朱棣之 2020-07-28 …
第二次工业革命和第三次科技革命的共同影响是A.第三产业比重超过第一、二产业B.推动国际经济格局的调整 2020-11-16 …
从早期的牲畜、布匹、贝壳等,到后来的贵金属金、银,都被大家普遍接受,充当商品交换的媒介。这些物品() 2020-11-28 …
材料一:历史是最好的教科书.2015年是世界反法西斯战争暨中国人民抗日战争胜利70周年.70年前的那 2020-12-04 …
小华家在黄土高原上,学校就在她家对面,但她每天却要绕道而行,这主要是因为黄土高原的地面上()A.河网 2020-12-08 …
截至2015年3月31日,中国倡议推动的亚洲基础设施投资银行“朋友圈”已达48个国家和地区.其创始成 2020-12-10 …