早教吧作业答案频道 -->化学-->
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+3
题目详情
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+
O2(g)⇌CO2(g)+2H2O(l)△H=-761kJ/mol;则CO(g)+2H2(g)⇌CH3OH(g)的△H=___.
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是___.
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是___.
A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
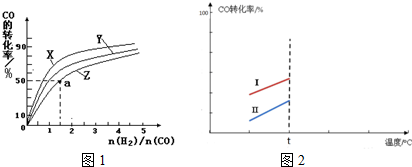
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律.图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线X对应的温度是___.
②利用图1中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+2H2(g)⇌CH3OH(g) 的平衡常数K=___.
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况.请在图2中补充t℃后的变化情况.
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+
| 3 |
| 2 |
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是___.
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是___.

A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律.图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线X对应的温度是___.
②利用图1中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+2H2(g)⇌CH3OH(g) 的平衡常数K=___.
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况.请在图2中补充t℃后的变化情况.
▼优质解答
答案和解析
(1)CO燃烧的热化学方程式:CO(g)+
O2(g)═CO2(g)△H=-283kJ•mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-761kJ•mol-1 ③
根据盖斯定律将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-90.8KJ•mol-1,
故答案为:-90.8 kJ/mol;
(2)A、反应前后质量和体积一直不变,所以密度一直不变,不能判断平衡,故A错误;
B、反应前后质量不变,但物质的量在变,所以平均相对分子质量保持不变,说明反应达平衡状态,故B正确;
C、生成CH3OH的速率与生成H2的速率等于系数之比,才能证明正逆反应速率相等,此时给定的条件不能判断平衡,故C错误;
D、CO体积分数保持不变,说明正逆反应速率相等,则反应达平衡状态,故D正确;
故选D;
(3)该可逆反应是反应前后气体体积减小的放热反应,
A.随时将CH3OH与反应混合物分离,平衡向正反应方向移动,但反应速率不变,故错误;
B.降低反应温度平衡向正反应方向移动,但反应速率减小,故错误;
C.恒容装置中充入H2,即增大体系压强,平衡向正反应方向移动且反应速率增大,故正确;
D.使用高效催化剂,反应速率增大,但平衡不移动,故错误;
故选C;
(4)①根据反应CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是300℃,
故答案是:300℃;
②该反应的平衡常数K=
,a点时,CO转化率50%,反应消耗了1mol×50%=0.5molCO,消耗氢气1mol,剩余n(H2)=1.5mol-1mol=0.5mol,生成0.5mol甲醇,a点各组分的浓度是:c(CH3OH)=0.25mol/L,c(CO)=0.25mol/L,c(H2)=0.25mol/L,
带人表达式得:K=
=16L2•mol-2,
故答案是:16;
(5)催化剂可以加快反应速率,但是不会引起化学平衡的移动,升高温度,化学平衡逆向移动,可以降低CO的转化率,t℃后的变化情况如下: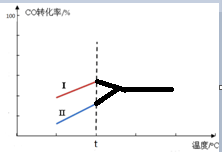 ,故答案为:
,故答案为: .
.
| 1 |
| 2 |
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
| 3 |
| 2 |
根据盖斯定律将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-90.8KJ•mol-1,
故答案为:-90.8 kJ/mol;
(2)A、反应前后质量和体积一直不变,所以密度一直不变,不能判断平衡,故A错误;
B、反应前后质量不变,但物质的量在变,所以平均相对分子质量保持不变,说明反应达平衡状态,故B正确;
C、生成CH3OH的速率与生成H2的速率等于系数之比,才能证明正逆反应速率相等,此时给定的条件不能判断平衡,故C错误;
D、CO体积分数保持不变,说明正逆反应速率相等,则反应达平衡状态,故D正确;
故选D;
(3)该可逆反应是反应前后气体体积减小的放热反应,
A.随时将CH3OH与反应混合物分离,平衡向正反应方向移动,但反应速率不变,故错误;
B.降低反应温度平衡向正反应方向移动,但反应速率减小,故错误;
C.恒容装置中充入H2,即增大体系压强,平衡向正反应方向移动且反应速率增大,故正确;
D.使用高效催化剂,反应速率增大,但平衡不移动,故错误;
故选C;
(4)①根据反应CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是300℃,
故答案是:300℃;
②该反应的平衡常数K=
| c(CH3OH) |
| c(CO)•c2(H2) |
带人表达式得:K=
| 0.25 |
| 0.25×0.252 |
故答案是:16;
(5)催化剂可以加快反应速率,但是不会引起化学平衡的移动,升高温度,化学平衡逆向移动,可以降低CO的转化率,t℃后的变化情况如下:
 ,故答案为:
,故答案为: .
.
看了 工业上一般以CO和H2为原料...的网友还看了以下:
二元一次方程组(急,快啊,马上给我,1.方程x+2y=7三个正整数解是2.已知方程(m-1)x(|m 2020-03-30 …
已知方程(m^2-4)x^2+(m+2)x+(m+1)y=m+5,当m为何值时,此方程是一元一次方 2020-05-13 …
韦达定理 已知一元二次方程8X-(m-1)X+M-7=0 M为何实数时,方程的两个根互为相反数一. 2020-05-16 …
关于x的方程(m的平方—4)x的平方+(m+2)x+(m+1)y=m+5 若该方程是一元一次方程, 2020-05-16 …
关于x的方程(m的平方-4)x平方+(m+2)x+(m+1)y=m+5关于x的方程(m的平方—4) 2020-06-12 …
已知抛物线C的顶点在原点,对称轴是y轴,抛物线上的点M(2,m)(m>0)到抛物线焦点F的距离为2 2020-07-26 …
已知关于X的方程(m的平方-1)x的平方-(m+1)x+m=0①x为何值时,此方程是一元一次方程已 2020-07-29 …
二元一次方程数学题1.已知方程ax+(b-2)y-3=0是关于x,y的二元一次方程,则有理数a≠( 2020-08-02 …
若7xm-n-p-4+1/2yp-m-n+16-9zn-m-p=13是三元一次方程,求m,n,p的 2020-08-03 …
已知关于x的方程(m^2-1)x^2-(m+1)x+m=0(1)m为何值时,此方程是一元—次已知关于 2020-11-12 …