早教吧作业答案频道 -->化学-->
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H1(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:化
题目详情
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
已知:N2(g)+O2(g)=2NO(g)△H3,则:△H1=___.
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为___;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应
4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)△H<0,相关数据如下:
①5~10min,用CO的浓度变化表示的反应速率为:___
②能说明上述反应达到平衡状态的是___
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时___(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=___
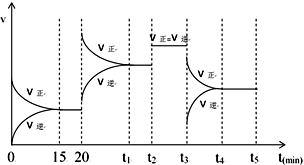
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:___;在时间15-20,t1-t2,t2-t3,t4-t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系:___.
2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H1

(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
| 化学键 | N≡N键 | O=O键 | N
| ||
| 键能kJ/•mol-1 | 945 | 498 | 630 |
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为___;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应
4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)△H<0,相关数据如下:
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②能说明上述反应达到平衡状态的是___
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时___(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=___
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:___;在时间15-20,t1-t2,t2-t3,t4-t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系:___.
▼优质解答
答案和解析
(1)焓变=反应物键能总和-生成物键能总和,则反应①N2(g)+O2(g)=2NO(g)△H3=945kJ/mol+498kJ/mol-630kJ/mol×2=+183 kJ•moL-1,CO的燃烧热△H2=-283kJ•moL-1,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ②,②-①得到2CO(g)+2NO(g)⇌N2(g)+2CO2(g),所以2CO(g)+2NO(g)⇌N2(g)+2CO2(g),△H1=-566kJ/mol-183 kJ•moL-1=-749kJ•moL-1,
故答案为:-749kJ•moL-1;
(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子浓度大小关系,得到电极反应式为;2CO-2e-+3OH-=HCO3-+H2O,故答案为:2CO-2e-+3OH-=HCO3-+H2O;
(3)①根据速率之比等于对应物质的化学计量数之比,v(CO)=4v(N2)=4×
=0.056mol/(L.min),故答案为:0.056mol/(L.min);
②A.2n正(NO2)=n逆(N2),速率之比不等于计量数之比,故错误;
B.混合气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故正确;
C.气体密度一直不变,故错误;
D.容器内气体压强不变,反应达平衡状态,故正确;故选:BD;
③20min时,向容器中加入1.0molNO2和1.0molCO,相当于增大压强,平衡向正反应方向移动,所以二氧化氮的转化率变大,故答案为:变大;
④4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)
初起浓度:2 2 0 0
变化浓度:1 0.5 0.25 1
平衡浓度:1 1.5 0.25 1
所以K=
=0.11,故答案为:0.11;
⑤t3时刻反应速率都减小,平衡正向移动,而正反应是放热反应,所以降低温度;平衡常数是温度的函数,正反应是放热反应,温度升高K值减小,其中15-20是增大压强,t1-t2是使用催化剂,t2-t3时降低温度,t4-t5时温度不变,所以K1、K2、K3、K4的大小关系为:降低温度;K1=K2=K3<K4.
故答案为:-749kJ•moL-1;
(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子浓度大小关系,得到电极反应式为;2CO-2e-+3OH-=HCO3-+H2O,故答案为:2CO-2e-+3OH-=HCO3-+H2O;
(3)①根据速率之比等于对应物质的化学计量数之比,v(CO)=4v(N2)=4×
| 0.22-0.15 |
| 10-5 |
②A.2n正(NO2)=n逆(N2),速率之比不等于计量数之比,故错误;
B.混合气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故正确;
C.气体密度一直不变,故错误;
D.容器内气体压强不变,反应达平衡状态,故正确;故选:BD;
③20min时,向容器中加入1.0molNO2和1.0molCO,相当于增大压强,平衡向正反应方向移动,所以二氧化氮的转化率变大,故答案为:变大;
④4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)
初起浓度:2 2 0 0
变化浓度:1 0.5 0.25 1
平衡浓度:1 1.5 0.25 1
所以K=
| 0.25×14 |
| 14×1.52 |
⑤t3时刻反应速率都减小,平衡正向移动,而正反应是放热反应,所以降低温度;平衡常数是温度的函数,正反应是放热反应,温度升高K值减小,其中15-20是增大压强,t1-t2是使用催化剂,t2-t3时降低温度,t4-t5时温度不变,所以K1、K2、K3、K4的大小关系为:降低温度;K1=K2=K3<K4.
看了 汽车尾气中排放的NxOy和C...的网友还看了以下:
已知汽油的热值是4.6×107J/kg,完全燃烧500g汽油,求:(1)燃烧汽油产生的热量是多少? 2020-05-13 …
32、已知一种汽油的热值是4.2×107J/kg,完全燃烧500g汽油,求;(1)燃烧汽油产生的热 2020-05-13 …
已知汽油的热值是4.6×107J/kg,完全燃烧500g汽油,求:(1)燃烧汽油产生的热量是多少? 2020-05-13 …
一辆汽车以100KM/H的速度沿水平路面匀速行驶,汽车受到1000N的阻力,汽车以这个速度行驶,每 2020-05-15 …
汽车以60km/h匀速直线运动,阻力为600N每行驶100km消耗汽油8L,完全燃烧1L汽油释放能 2020-05-16 …
一辆作匀加速直线运动的汽车,在6s内通过相隔60m远的两点,已知汽车经过第二点时的速率为15m/s 2020-06-15 …
一辆小轿车以某一速度匀速行驶100km,消耗7kg汽油,若这些汽油完全燃烧,汽油的热值是4.6×1 2020-07-18 …
已知汽油的热值是4.6×107J/kg,完全燃烧500g汽油,求:(1)燃烧汽油产生的热量是多少? 2020-07-18 …
(2012•河东区二模)一台汽油机工作时的功率为P,在t时间内烧掉汽油的质量为m,如果汽油的热值是q 2020-12-14 …
1.做自由落体运动的物体,第1秒内的位移是:m,第2秒内的位移是:m,第2秒的末速度是:m/s,第2 2021-01-22 …