早教吧作业答案频道 -->化学-->
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.(1)直流电源中,N为极.(2)AgNO3溶液
题目详情
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.
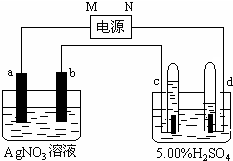
(1)直流电源中,N为___极.
(2)AgNO3溶液的浓度___(填增大、减小或不变.下同),H2SO4溶液的pH___,若要硫酸恢复成原溶液需加入___
(3)Pt电极上生成的物质是___,其质量为___g.

(1)直流电源中,N为___极.
(2)AgNO3溶液的浓度___(填增大、减小或不变.下同),H2SO4溶液的pH___,若要硫酸恢复成原溶液需加入___
(3)Pt电极上生成的物质是___,其质量为___g.
▼优质解答
答案和解析
根据题意知,电解稀硫酸时,实际上电解的是水,在c、d两极上共收集到336mL并且c少d多,则c收集的为氧气,d收集的为氢气,所以c为阳极,d为阴极,所以M为正极,N为负极,活性电极Ag作阳极,Pt电极作阴极即a作阳极,b为阴极;
(1)根据以上分析,N为负极;
故答案为:负;
(2)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,所以硝酸银溶液的浓度不变;电解稀硫酸溶液时,阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,溶液中的溶质不变,溶剂减少,导致稀硫酸的浓度增大,溶液的pH值减小;若要硫酸恢复成原溶液需加入H2O;
故答案为:不变;减小;H2O;
(2)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O
2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的
,所以混合气体中氢气的体积是224mL,根据2H++2e-═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
Ag++e-=Ag
1mol 108g
0.02mol 2.16g
故答案为:银; 2.16.
(1)根据以上分析,N为负极;
故答案为:负;
(2)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,所以硝酸银溶液的浓度不变;电解稀硫酸溶液时,阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,溶液中的溶质不变,溶剂减少,导致稀硫酸的浓度增大,溶液的pH值减小;若要硫酸恢复成原溶液需加入H2O;
故答案为:不变;减小;H2O;
(2)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O
| ||
| 2 |
| 3 |
Ag++e-=Ag
1mol 108g
0.02mol 2.16g
故答案为:银; 2.16.
看了 如图中电极a、b分别为Ag电...的网友还看了以下:
把干的蚕豆放在清水中浸泡胀大以后,用手紧捏蚕豆种子的两侧,会发现有水滴从种脐一端的小孔(叫种孔)中 2020-06-26 …
明朝中后期,王阳明学说在中国士大夫中流行.朝鲜来华使者对此不理解,认为“阳明敢肆己意,谤辱朱子,实 2020-07-06 …
下图示意某流域径流过程的不同环节,读图回答小题。小题1:图中甲、乙、丙三个环节分别是()A.下渗、坡 2020-11-08 …
读我国30°N附近甲山坡植被和聚落数量分布示意图,回答5~6题。5.甲山坡海拔2000~3000米地 2020-11-10 …
如图是某台式饮水机的结构示意图.控水槽中浮体与阀门固定相连,水桶中水流向控水槽使浮体和阀门上升,控水 2020-11-10 …
图是一台饮水机的结构示意图,控水槽中浮体与阀门固定相连,水桶中水流向控水槽使浮体和阀门上升,控水槽中 2020-11-10 …
(2012•三元区模拟)今年3月,三明地区某些学校有学生患了流行性腮腺炎.流行性腮腺炎(简称“流腮” 2020-11-12 …
下图示意某流域径流过程的不同环节,读图回答小题。1.图中甲、乙、丙三个环节分别是()A.下渗、坡面流 2020-11-26 …
下图示意某流域径流过程的不同环节。读图,回答下列各题。1.图中甲、乙、丙三个环节分别是()A.下渗、 2020-11-26 …
下列句子中加粗词意义用法相同的一组是[]A.木兰当户织——有大石当中流B.将献公堂,惴惴恐不当意—— 2020-12-03 …