早教吧作业答案频道 -->化学-->
用NH3催化还原NxOy可以消除氮氧化物的污染.已知:反应Ⅰ:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2(且|△H1|=2|△H2|)反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2
题目详情
用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
(1)推测反应Ⅲ是___反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.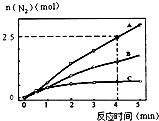
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=___.
②下列说法正确的是___.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)___;恒温恒容容器,φ(NO2)___.
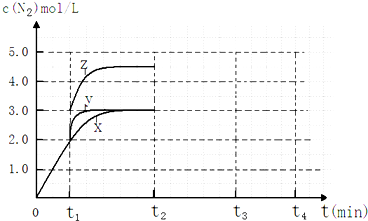
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是___.变为曲线Z改变的条件是___.
②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2-t4内 c(N2)的变化曲线.
已知:反应Ⅰ:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=___.
②下列说法正确的是___.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)___;恒温恒容容器,φ(NO2)___.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是___.变为曲线Z改变的条件是___.

②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2-t4内 c(N2)的变化曲线.
▼优质解答
答案和解析
(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I-反应II×3得到反应III,则△H3=△H1-3△H2,已知|△H1|=2|△H2|,所以△H3=△H1-3△H2=|△H2|>0,即反应III为吸热反应,故答案为:吸热;
(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)=
=
=0.375mol•L-1•min-1,故答案为:0.375mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)一定条件下,反应II2NO(g)+O2(g)⇌2NO2(g)达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,恒温恒压条件下,再充入NO2气体,则与原来的平衡为等效平衡,则NO2体积分数与原来平衡相同;若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大;
故答案为:不变;变大;
(4)①分析图象可知曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,反应中体积是可变的,已知是恒压容器,说明改变的是加入了催化剂;
当曲线X变为曲线Z时N2物质的量浓度增大,可变容器中气体体积和浓度成反比,曲线X,体积为3L,N2浓度为3mol/L,改变条件当曲线X变为曲线Z时,N2浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L;
图象分析曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线X变为曲线Z时N2物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变;
②反应III为吸热反应,若t2降低温度,则平衡逆向移动,氮气的浓度减小,在t3达到平衡,曲线X在t2-t4内 c(N2)的变化曲线为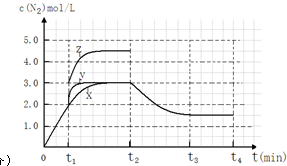 ,故答案为:
,故答案为: .
.
(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)=
| △c |
| △t |
| ||
| 4min |
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)一定条件下,反应II2NO(g)+O2(g)⇌2NO2(g)达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,恒温恒压条件下,再充入NO2气体,则与原来的平衡为等效平衡,则NO2体积分数与原来平衡相同;若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大;
故答案为:不变;变大;
(4)①分析图象可知曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,反应中体积是可变的,已知是恒压容器,说明改变的是加入了催化剂;
当曲线X变为曲线Z时N2物质的量浓度增大,可变容器中气体体积和浓度成反比,曲线X,体积为3L,N2浓度为3mol/L,改变条件当曲线X变为曲线Z时,N2浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L;
图象分析曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线X变为曲线Z时N2物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变;
②反应III为吸热反应,若t2降低温度,则平衡逆向移动,氮气的浓度减小,在t3达到平衡,曲线X在t2-t4内 c(N2)的变化曲线为
 ,故答案为:
,故答案为: .
.
看了 用NH3催化还原NxOy可以...的网友还看了以下:
(1/(n^2 n 1 ) 2/(n^2 n 2) 3/(n^2 n 3) ……n/(n^2 n 2020-05-16 …
已知等差数列an的前n项和为18,若S3=1,a(n)+a(n-1)+a(n-2)=3,则n等于a 2020-05-17 …
nC0+nC1+nC2+.+nCn+3^n*nC0+3^(n-1)*nC1+3^(n-2)*nC2 2020-06-12 …
已知a1=5,an=2an-1+3^n,求{an}的通项公式an=2an-1+3^n两边同加3^n 2020-07-22 …
Tn=3×3+5×3^2+7×3^3+.+(2n-1)×3^n-1+(2n+1)×3^n(3^2表 2020-07-29 …
几个数学问题,请高手回答一下.1.1^2+2^2+3^2+4^2+……(N-1)^2=[(N-1) 2020-07-31 …
问一个关于平方和公式推导过程中的小问题利用(n+1)^3=n^3+3n^2+3n+1推导时,(n+ 2020-07-31 …
1+2+3+4+5+.+n=0.5n^2+n1^2+2^2+3^2.+n^2=n(n+1)(2n+ 2020-08-03 …
1.(x+y)^4+x^4+y^4=2(x^2+xy+y^2)^22.(x-2y)x^3-(y-2x 2020-11-03 …
求数列an=n(n+1)的前n项和.an=n(n+1)=[n(n+1)(n+2)-(n-1)n(n+ 2020-12-03 …