硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:回答下列问题:(1)写出Mg2
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_________。为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_________(写出两条)。
(2)利用__________的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是__________。(写化学式)
(3)“净化除杂”需先加H2O2溶液,作用是__________________。然后再调节溶液的pH约为5,目的是________________。
(4)“粗硼酸”中的主要杂质是__________(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为__________。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程_________。
[解析] (1)硫酸可与硼酸盐反应制取酸性较弱的硼酸,所以Mg2B2O5·H2O与硫酸反应的化学方程式为:Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3。为提高浸出速率,除适当增加硫酸浓度外,还可采取提高反应温度、减小铁硼矿粉粒径等措施。
2MgSO4+2H3BO3。为提高浸出速率,除适当增加硫酸浓度外,还可采取提高反应温度、减小铁硼矿粉粒径等措施。
(2)Fe3O4有磁性,可利用其磁性将其从“浸渣”中分离;“浸渣”中还剩余的物质是SiO2和CaSO4。
(3)“净化除杂”需先加H2O2溶液,其作用是把Fe2+氧化为Fe3+,然后调节溶液的pH约为5,使Al3+和Fe3+以Al(OH)3、Fe(OH)3形式沉降而除去。
(4)“粗硼酸”中所含杂质主要是没有除去的易溶性镁盐,故为(七水)硫酸镁。
(5)硼氢化钠的电子式为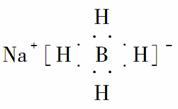 。
。
(6)利用Mg的还原性制取硼的化学方程式为2H3BO3![]() B2O3+3H2O、B2O3+3Mg
B2O3+3H2O、B2O3+3Mg![]() 2B+3MgO。
2B+3MgO。
[答案] (1)Mg2B2O5·H2O+2H2SO4![]() 2H3BO3+2MgSO4 提高反应温度、减小铁硼矿粉粒径
2H3BO3+2MgSO4 提高反应温度、减小铁硼矿粉粒径
(2)Fe3O4 SiO2和CaSO4
(3)将Fe2+氧化成Fe3+ 使Fe3+与Al3+形成氢氧化物沉淀而除去
(4)(七水)硫酸镁
(5) 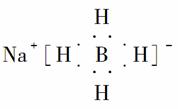
(6)2H3BO3![]() B2O3+3H2O、B2O3+3Mg
B2O3+3H2O、B2O3+3Mg![]() 2B+3MgO
2B+3MgO
盒中原有7个小球,魔术师从中取出若干个球,把每个球都变成7个小球,将其放回盒中;他又由其中取出若干个 2020-03-30 …
1.PT切圆O于T,CT为直径,D为OC上的一点,支线PD交圆O于B和A,B在线段PD上,若CD= 2020-04-12 …
O、A、B、C为空间四个点,又OA、OB、OC为空间的一个基底,则()A.O、A、B、C四点不共线 2020-05-14 …
色谱在其它条件不变得情况下,若柱长增加一倍,色谱峰的宽度为原色谱峰宽度的在其它条件不变得情况下, 2020-06-18 …
行测逻辑题目小明忘记了今天是星期几,于是他去问o、p、q三人.O回答:“我也忘记今天是星期几了,但 2020-06-27 …
"贤哉回也!一箪食,一瓢饮,在陋巷,人不堪其忧,回也不改其乐.贤哉回也.”找出一个至今沿用的成语从 2020-07-02 …
请翻成白话文其一七绝崎岖世路已难行,况复衰颓马望成,远道瑶章多策勉,内心愧感莫能京.其二七绝白首心 2020-07-03 …
python编写一个函数mysum2,其功能是根据给定的数N求得从1到N间所有能被3整除的数的和, 2020-07-17 …
大气臭氧层的反应是:O+O3=2O2△H,该反应的能量变化如图所示,下列叙述中,正确的是()A.O+ 2020-10-31 …
图甲是测定夏季某植物一昼夜氧气释放速率的装置示意图,其中小室由透明玻璃材料制成.图乙是把相关数据整理 2020-11-10 …