如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是()A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(Cl
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )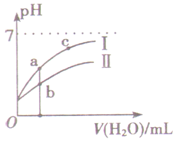
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 等浓度等体积的CH3COONa和NaClO两种溶液中,阴离子的总物质的量前者小于后者
C. 图中a、b两点对应的酸的物质的量浓度a>b
D. 图中a、c两点的溶液中
相等(HR代表CH3COOH或HClO)c(R-) c(HR)•c(OH-)
B.HClO的酸性比CH3COOH的酸性弱,由越弱越水解知,醋酸钠的水解程度小于氢氰酸钠的水解程度,ClO-+H2O⇌HClO+OH-,CH3COO-+H2O⇌CH3COOH+OH-,CH3COONa溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),NaClO溶液中c(Na+)+c(H+)=c(ClO-)+c(OH-),钠离子的浓度不变且相等,ClO-的水解程度较大,溶液中OH-的浓度较大,H+的浓度较小,故阳离子的浓度之和较小,则CH3COONa溶液中阴离子的总物质的量大于NaClO,故B错误;
C.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故C错误;
D.
| c(R-) |
| c(OH-)c(HR) |
| c(R-) |
| c(OH-)c(HR) |
| c(H+) |
| c(H+) |
| Ka |
| Kw |
故选D.
元素的定义是核电荷数相同的原子总称,那么离子和原子是否有区别?Na+是不是Na元素?“Na+是Na 2020-04-25 …
有几个;1,氢氧化铁与硫酸钠为什么不会反应?那氢氧化钠与硫酸铁呢?那碳酸钠和硫酸铜呢?2,离子扩散 2020-05-20 …
设NA是阿伏加德罗常数的数值.下列说法正确的是()A.用惰性电极电解CuSO4溶液后,如果加入0. 2020-07-09 …
某混合物是由NaCl、MgCl2、AlCl3三种物质组成的,Na、Mg、Al三种元素的质量比为23 2020-07-11 …
设NA是阿伏加德罗常数的数值.下列说法正确的是()A.用惰性电极电解CuSO4溶液后,如果加入0. 2020-07-16 …
32gO2和O3的混合气体中有O的数目怎么就成2NA了NA是阿伏加德罗常数..这类题怎么做啊.还有 2020-07-17 …
设NA是阿伏加德罗常数的数值.下列说法正确的是()A.标准状况下,22.4L庚烷完全燃烧生成二氧化碳 2020-10-31 …
为什么常温常压下14g由N2和CO组成的混合气体含有的原子数目为NA是对的而常温常压下,22.4L的 2020-11-17 …
证明:任何实数a都是一个有理数列的极限,也是一个无理数列的极限.有一个提示是:na-1<[na]≤n 2020-11-21 …
关于,发音的知识.元音字母在非重读音节中比如[E]1.Chinachina分两个音节?na是非重读音 2020-12-04 …