早教吧作业答案频道 -->化学-->
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体g.(1)在该溶液的配制过程中,用到的玻璃仪器:、胶头滴管、量筒、烧杯、玻璃棒.(2)如果在定容时仰视,溶液浓度将;若定
题目详情
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体___g.
(1)在该溶液的配制过程中,用到的玻璃仪器:___、胶头滴管、量筒、烧杯、玻璃棒.
(2)如果在定容时仰视,溶液浓度将___;若定容时液面高于刻度线应采取的措施是___.
Ⅱ、取上述实验中配制的NaOH溶液100mL,缓慢通入一定量的CO2,充分反应,测得最后溶液呈碱性.
(1)此时溶液的溶质若是单一成分,可能是___或___.
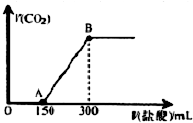
(2)若果在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示.
①由图可知,碱性溶液中的单一溶质为___.
②请写出0-A段所发生反应的离子方程式___.
③B点时,产生的CO2在标准状况下的体积为___mL;B点时,反应所得溶液中溶质的物质的量浓度是___mol/L(两种溶液混合时体积可以直接相加)

(1)在该溶液的配制过程中,用到的玻璃仪器:___、胶头滴管、量筒、烧杯、玻璃棒.
(2)如果在定容时仰视,溶液浓度将___;若定容时液面高于刻度线应采取的措施是___.
Ⅱ、取上述实验中配制的NaOH溶液100mL,缓慢通入一定量的CO2,充分反应,测得最后溶液呈碱性.
(1)此时溶液的溶质若是单一成分,可能是___或___.
(2)若果在上述所得溶液中,逐滴缓慢滴加1mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示.
①由图可知,碱性溶液中的单一溶质为___.
②请写出0-A段所发生反应的离子方程式___.
③B点时,产生的CO2在标准状况下的体积为___mL;B点时,反应所得溶液中溶质的物质的量浓度是___mol/L(两种溶液混合时体积可以直接相加)
▼优质解答
答案和解析
I、配制3mol/L的NaOH溶液500mL,所需的氢氧化钠的物质的量n=cV=3mol/L×0.5L=1.5mol,质量m=nM=1.5mol×40g/mol=60.0g,故答案为:60.0;
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有500mL容量瓶和胶头滴管、量筒、烧杯、玻璃棒,故答案为:500mL容量瓶;
(2)如果在定容时仰视,则溶液体积将偏大,溶液浓度将偏小;若定容时液面高于刻度线应采取的措施是重新配制,故答案为:偏小,重新配制;
II、(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是Na2CO3或NaHCO3,
故答案为:Na2CO3或NaHCO3;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,无气体产生和生成气体段所需的盐酸的体积比为1:1,可知溶液中的溶质为Na2CO3,O→A段发生反应:Na2CO3+HCl═NaCl+NaHCO3,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑.
①根据图象可知,加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,无气体产生和生成气体段所需的盐酸的体积比为1:1,可知溶液中的溶质为Na2CO3,故可推知单一的溶质为Na2CO3,故答案为:Na2CO3;
②O→A段发生反应:Na2CO3+HCl═NaCl+NaHCO3,故离子方程式为:CO32-+H+═HCO3-,故答案为:CO32-+H+═HCO3-;
③A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,消耗盐酸的体积为150mL,物质的量n=CV=1mol/L×0.15L=0.15mol,设生成的二氧化碳的物质的量为xmol,则有:
NaHCO3+HCl═NaCl+H2O+CO2↑
1 1
0.15mol xmol
故有:
=
解得x=0.15mol.
0.15mol二氧化碳在标况下的体积V=nVm=0.15mol×22.4L/mol=3360mL;
B点溶液中溶质为NaCl,由钠离子守恒可知n(NaCl)=n(NaOH)=0.1L×3mol/L=0.3mol,则NaCl的物质的量浓度是:
=0.75mol/L,
故答案为:3360mL;0.75mol/L.
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有500mL容量瓶和胶头滴管、量筒、烧杯、玻璃棒,故答案为:500mL容量瓶;
(2)如果在定容时仰视,则溶液体积将偏大,溶液浓度将偏小;若定容时液面高于刻度线应采取的措施是重新配制,故答案为:偏小,重新配制;
II、(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是Na2CO3或NaHCO3,
故答案为:Na2CO3或NaHCO3;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,无气体产生和生成气体段所需的盐酸的体积比为1:1,可知溶液中的溶质为Na2CO3,O→A段发生反应:Na2CO3+HCl═NaCl+NaHCO3,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑.
①根据图象可知,加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,无气体产生和生成气体段所需的盐酸的体积比为1:1,可知溶液中的溶质为Na2CO3,故可推知单一的溶质为Na2CO3,故答案为:Na2CO3;
②O→A段发生反应:Na2CO3+HCl═NaCl+NaHCO3,故离子方程式为:CO32-+H+═HCO3-,故答案为:CO32-+H+═HCO3-;
③A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,消耗盐酸的体积为150mL,物质的量n=CV=1mol/L×0.15L=0.15mol,设生成的二氧化碳的物质的量为xmol,则有:
NaHCO3+HCl═NaCl+H2O+CO2↑
1 1
0.15mol xmol
故有:
| 1 |
| 0.15mol |
| 1 |
| xmol |
解得x=0.15mol.
0.15mol二氧化碳在标况下的体积V=nVm=0.15mol×22.4L/mol=3360mL;
B点溶液中溶质为NaCl,由钠离子守恒可知n(NaCl)=n(NaOH)=0.1L×3mol/L=0.3mol,则NaCl的物质的量浓度是:
| 0.3mol |
| 0.1L+0.3L |
故答案为:3360mL;0.75mol/L.
看了 Ⅰ、如果配制3mol/L的N...的网友还看了以下:
已知⊙O过点D(4,3),点H与点D关于x轴对称,过H作⊙O的切线交x轴于点A.(1)求sin∠H 2020-05-13 …
已知⊙O过点D(3,4),点H与点D关于x轴对称,过H作⊙O的切线交x轴于点A.(1)求直线HA的 2020-05-13 …
(2006•宁波)已知⊙O过点D(4,3),点H与点D关于y轴对称,过H作⊙O的切线交y轴于点A( 2020-05-13 …
已知⊙O过点D(4,3),点H与点D关于y轴对称,过H作⊙O的切线交y轴于点A(如图1).(1)求 2020-05-13 …
下列有关化学用语或名称表达正确的是()A.聚丙烯的结构简式:B.乙炔的分子结构模型示意图:C.H2 2020-05-14 …
18、下列关于维生素C(C6H8O6,简称Vc)的说法中,正确的是()A、C6H8O6是由C、H、 2020-05-14 …
进行下列数的数制转换(213)D=()B=()H=()O(69.625)D=()B=()H=()O 2020-05-21 …
H-O-H,每mol水中含2molH-O键含2mol的H-O键,H-O-H中的H-O?H-O是什么 2020-06-28 …
进制换算(213)D=()B=()H=()O(69.625)D=()D=()B=()O(127)D 2020-07-19 …
参与蛋白质分子中α-螺旋的氢键形成是A.每个肽键的N-H的H和其后第三个肽键的C=O的OB.每个肽 2020-07-21 …