早教吧作业答案频道 -->化学-->
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是.(2)调节pH,实验记录如下:实验pH现象a10产生白色
题目详情
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
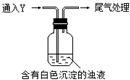
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是___.
(2)调节pH,实验记录如下:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是___.
②推测a中白色沉淀为Ag2SO4,推测的依据是___.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于___溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是___.
②根据上述现象,分析X的性质和元素组成是___.
③Ⅱ中反应的化学方程式是___.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是___.
②白色沉淀转化为X的化学方程式是___.

(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是___.
(2)调节pH,实验记录如下:
| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是___.
②推测a中白色沉淀为Ag2SO4,推测的依据是___.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于___溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是___.
②根据上述现象,分析X的性质和元素组成是___.
③Ⅱ中反应的化学方程式是___.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是___.
②白色沉淀转化为X的化学方程式是___.
▼优质解答
答案和解析
(1)Na2SO3为强碱弱酸盐,在溶液中水解显碱性,则溶液的pH=10,其水解离子方程为:SO32-+H2O⇌HSO3-+OH-,AgNO3为强酸弱碱盐,在溶液中pH=5,其水解离子方程为:Ag++H2O⇌H++AgOH,
故答案为:SO32-、Ag+;
(2)①推测a中白色沉淀为Ag2SO3,Ag+与SO32-反应生成Ag2SO3,Ag2SO3溶于过量的Na2SO3溶液,生成沉淀的离子方程式为:2Ag++SO32-=Ag2SO3↓,
故答案为:2Ag++SO32-=Ag2SO3↓;
②推测a中白色沉淀为Ag2SO4,其依据为:SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀,
故答案为:SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀;
(3)Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液,取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解,说明B、C中白色沉淀为Ag2SO3,另取Ag2SO4固体,同样条件置于足量Na2SO3溶液中,进行对照试验,发现沉淀不溶解,
故答案为:Na2SO3;
(4)①氧化银能和盐酸生成白色氯化银沉淀和水,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,
故答案为:检验X是否为Ag2O;
②向X中加入过量浓HNO3,产生红棕色气体为NO2,X与浓硝酸发生氧化还原反应,X具有还原性,X只能为金属单质,只能为银,含有Ag元素,不含S元素,
故答案为:有还原性; 含有Ag元素,不含S元素;
③向X中加入过量浓HNO3,产生红棕色气体为NO2,银和硝酸反应,氮元素从+5变为+4价,同时生成硝酸银和水,反应方程式为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O,
故答案为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O;
(5)①海绵状棕黑色物质X为Ag,产生Ag的原因,可能为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化,实验确认,可通+4价硫的氧化物二氧化硫进行实验确认,通入二氧化硫后,瓶中白色沉淀Ag2SO3转化为棕黑色Ag,
故答案为:SO2;
②X为Ag,白色沉淀转化为X,为在酸性条件下,亚硫酸银中+4价的硫,被+1价银氧化生成银和硫酸,反应为:Ag2SO3+H2O=2Ag+H2SO4,
故答案为:Ag2SO3+H2O=2Ag+H2SO4.
故答案为:SO32-、Ag+;
(2)①推测a中白色沉淀为Ag2SO3,Ag+与SO32-反应生成Ag2SO3,Ag2SO3溶于过量的Na2SO3溶液,生成沉淀的离子方程式为:2Ag++SO32-=Ag2SO3↓,
故答案为:2Ag++SO32-=Ag2SO3↓;
②推测a中白色沉淀为Ag2SO4,其依据为:SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀,
故答案为:SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀;
(3)Ag2SO3白色,难溶于水,溶于过量Na2SO3的溶液,取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解,说明B、C中白色沉淀为Ag2SO3,另取Ag2SO4固体,同样条件置于足量Na2SO3溶液中,进行对照试验,发现沉淀不溶解,
故答案为:Na2SO3;
(4)①氧化银能和盐酸生成白色氯化银沉淀和水,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,
故答案为:检验X是否为Ag2O;
②向X中加入过量浓HNO3,产生红棕色气体为NO2,X与浓硝酸发生氧化还原反应,X具有还原性,X只能为金属单质,只能为银,含有Ag元素,不含S元素,
故答案为:有还原性; 含有Ag元素,不含S元素;
③向X中加入过量浓HNO3,产生红棕色气体为NO2,银和硝酸反应,氮元素从+5变为+4价,同时生成硝酸银和水,反应方程式为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O,
故答案为:Ag+2HNO3(浓)═AgNO3+NO2↑+H2O;
(5)①海绵状棕黑色物质X为Ag,产生Ag的原因,可能为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化,实验确认,可通+4价硫的氧化物二氧化硫进行实验确认,通入二氧化硫后,瓶中白色沉淀Ag2SO3转化为棕黑色Ag,
故答案为:SO2;
②X为Ag,白色沉淀转化为X,为在酸性条件下,亚硫酸银中+4价的硫,被+1价银氧化生成银和硫酸,反应为:Ag2SO3+H2O=2Ag+H2SO4,
故答案为:Ag2SO3+H2O=2Ag+H2SO4.
看了 某学生对Na2SO3与AgN...的网友还看了以下:
判断由下列命题构成的p∨q,p∧q,非p形式的命题的真假:(1)p:负数的平方是正数,q:有理数是 2020-04-06 …
概率题急求解1设A,B为随机事件且P(A)=0.7,P(A-B)=0.3,求P(A非B非).2设A 2020-04-12 …
若有以下定义,则值为4的表达式是 A)p+=3,*(p++) B)p+=3,*++p C)p+=4 2020-05-13 …
在下列各题中,请作出判断并说明理由.(1)p:x2-2x-3<0q:|x|>3则p是q的什么条件; 2020-05-15 …
P(A)=3/4,P(B)=5/6的条件下求P(A∩B)P(A)=3/4,P(B)=5/6的条件下 2020-05-19 …
下列命题中,P是Q的什么条件?(1)P:x=1.Q:x-1=√x-1(2)P:|x-2|≥3,Q: 2020-07-29 …
求助一个关于积分上下限的问题首先有这个积分:∫12*(p+(1/4))^2*((3/4)-p)dp 2020-07-31 …
某科考队结束了两个月的海上考察,于4月21日返回到P地。图3为P地所在区域当日某时地面形势图。读图回 2020-11-06 …
写出下列命题,并判断它们的真假:(1)p∨q,这里p:4∈{2,3},q:2∈{2,3};(2)p∧ 2020-12-13 …
有变量定义如下,inta[2][3],*p,(*q)[3];以下赋值语句错误的是A.p=a;有变量定 2020-12-31 …