早教吧作业答案频道 -->化学-->
铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研究和工业生产中具有许多用途.根据所学知识回答下列问题:(1)基态铁原子的
题目详情
铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研究和工业生产中具有许多用途.根据所学知识回答下列问题:
(1)基态铁原子的电子占据最高的能层的符号为___,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素有___种.
(2)下列关于铁的说法,正确的是___(填选项字母)
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2肯定违反了泡利原理
B.铁属于黑色金属,在周期表中属于d区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,1mol Fe(CO)5中含有的σ键数是5NA
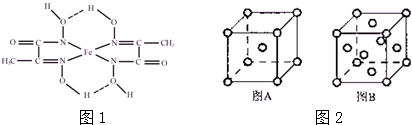
(3)某铁的化合物结构简式如下图1所示
①组成上述化合物各元素原子电负性由大到小的顺序为___.
②上述化合物中氮原子的杂化方式为___.
③在图中用“→”标出亚铁离子的配位键.
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N )和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是___.
(5)铁单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图2中A、B所示,若铁原子的半径是rcm,则这两种晶体密度之比是___.

(1)基态铁原子的电子占据最高的能层的符号为___,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素有___种.
(2)下列关于铁的说法,正确的是___(填选项字母)
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2肯定违反了泡利原理
B.铁属于黑色金属,在周期表中属于d区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,1mol Fe(CO)5中含有的σ键数是5NA
(3)某铁的化合物结构简式如下图1所示
①组成上述化合物各元素原子电负性由大到小的顺序为___.
②上述化合物中氮原子的杂化方式为___.
③在图中用“→”标出亚铁离子的配位键.
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N )和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是___.
(5)铁单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图2中A、B所示,若铁原子的半径是rcm,则这两种晶体密度之比是___.
▼优质解答
答案和解析
(1)Fe原子的电子排布式是1s22s22p63s23p63d64s2,电子占据最高的能层的符号为N,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素的3d轨道电子数为1、2、3、5、10,还有5种,
故答案为:N;5;
(2)A.3p能级有3个轨道,最多容纳6个电子,选项中排列违反了泡利原理,故A正确;
B.黑色金属包括铁、铬、锰,d区元素包括ⅢB~ⅦB、Ⅷ族元素,故B正确;
C.铁的焰色反应焰色反应发出的光不影响其它金属火焰颜色,故C错误
D.Fe(CO)5分子含有5个配位键,而CO分子中含有1个σ键,1molFe(CO)5中含有的σ键数是6NA,故D错误,
故选:AB;
(3)①非金属性越强,元素的电负性越大,则电负性O>N>C>H>Fe,故答案为:O>N>C>H>Fe;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化,
故答案为:sp2、sp3;
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外N原子带1个单位负电荷,与亚铁离子之间形成离子键,标出亚铁离子的配位键为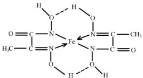 ,
,
故答案为: ;
;
(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸,
故答案为:异硫氰酸;
(5)图A体心立方密堆积,晶胞中Fe原子数目为1+8×
=2,晶胞棱长长度为
cm,图B为面心立方密堆积,晶胞中Fe原子数目为8×
+6×
=4,晶胞棱长长度为
×4r=2
r cm,晶胞质量之比为2:4=1:2,则A、B两种晶体密度之比是
:
=
,
故答案为:
故答案为:N;5;
(2)A.3p能级有3个轨道,最多容纳6个电子,选项中排列违反了泡利原理,故A正确;
B.黑色金属包括铁、铬、锰,d区元素包括ⅢB~ⅦB、Ⅷ族元素,故B正确;
C.铁的焰色反应焰色反应发出的光不影响其它金属火焰颜色,故C错误
D.Fe(CO)5分子含有5个配位键,而CO分子中含有1个σ键,1molFe(CO)5中含有的σ键数是6NA,故D错误,
故选:AB;
(3)①非金属性越强,元素的电负性越大,则电负性O>N>C>H>Fe,故答案为:O>N>C>H>Fe;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化,
故答案为:sp2、sp3;
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外N原子带1个单位负电荷,与亚铁离子之间形成离子键,标出亚铁离子的配位键为
 ,
,故答案为:
 ;
;(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸,
故答案为:异硫氰酸;
(5)图A体心立方密堆积,晶胞中Fe原子数目为1+8×
| 1 |
| 8 |
| 4r | ||
|
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 2 |
| 2 |
| 1 | ||||
(
|
| 2 | ||
(2
|
3
| ||
| 8 |
故答案为:
| 3 |
看了 铁与人类密切相关,几乎无处不...的网友还看了以下:
一空心导体球壳,其内、外半径分别为R1和R2,带电荷q,如图所示.当球壳中心处再放一电荷为q的点电 2020-05-16 …
鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小刚和小勇同学进行了如下实验。实验过程和 2020-05-16 …
10g蛋壳加盐酸100g充分反后后剩余106.7g过滤洗涤干燥后蛋壳残杂4.3g小刚根据蛋壳残渣4 2020-06-06 …
如图所示,是地壳里所含各种元素的质量分数.请根据图回答下列问题:(1)图中表示出的金属有66种.( 2020-06-16 …
鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小勇同学进行了如下实验。请回答相关问题: 2020-06-29 …
碳在地壳中的含量不高,但它的化合物数量众多,而且分布极广.根据所学知识回答:(1)图①为碳原子的结 2020-07-08 …
如图是地壳中各元素的含量(质量分数)示意图,据此判断下列说法正确的是()A.地壳中含量最多的元素是 2020-07-18 …
为了测定某种贝壳中碳酸钙的质量分数,取贝壳15克,加入150克7.3%的盐酸溶液,充分反应后,称得 2020-07-18 …
铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研 2020-07-22 …
碳在地壳中的含量不高,但它的化合物数量众多.而且分布极广.根据如图及所学知识回答下列问题:(1)图 2020-07-29 …
 扫描下载二维码
扫描下载二维码