早教吧作业答案频道 -->化学-->
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.(1)一定温度下,在两个
题目详情
“C 1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
请回答:
①a=___.
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___mol•L-1•S-1.
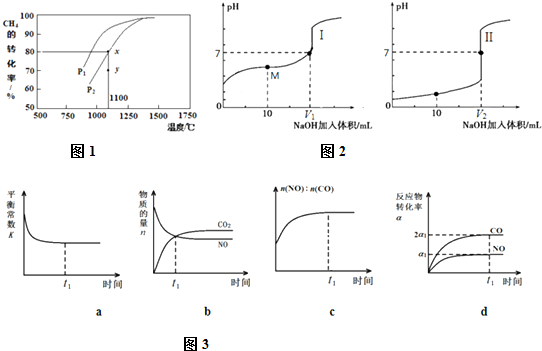
(2)甲烷的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图1所示,则压强P1___P2(填“大于”或“小于”);压强为P2时,在y点:v(正)___v(逆)(填“大于”、“小于”或“等于”).
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象如图3正确且能说明反应在进行到t1时刻一定达到平衡状态的是___(选填字母).
(4)甲酸(HCOOH)是一种弱酸,现用0.1mol•L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和甲酸溶液,滴定曲线如图2:
滴定开始前,三种溶液中由水电离出的c(H+)最大的是___;V1和V2的关系V1___V2(填
“>”、“=”或“<”);M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___.

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①a=___.
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___mol•L-1•S-1.
(2)甲烷的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图1所示,则压强P1___P2(填“大于”或“小于”);压强为P2时,在y点:v(正)___v(逆)(填“大于”、“小于”或“等于”).
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象如图3正确且能说明反应在进行到t1时刻一定达到平衡状态的是___(选填字母).
(4)甲酸(HCOOH)是一种弱酸,现用0.1mol•L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和甲酸溶液,滴定曲线如图2:
滴定开始前,三种溶液中由水电离出的c(H+)最大的是___;V1和V2的关系V1___V2(填
“>”、“=”或“<”);M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___.
▼优质解答
答案和解析
(1)①甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ,则a=49.0kJ-29.4kJ=19.6kJ,故答案为:19.6;
②平衡时能量变化放出29.4kJ,所以反应二氧化碳的物质的量为
=0.6mol,所以,然后求平均反应速率v=
=0.03mol/(L•min),故答案为:0.03;
(2)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
故答案为:小于;大于;
(3)当反应前后改变的物理量不变时,该可逆反应达到平衡状态,
a中为平衡常数,平衡常数与温度有关,温度不变,则平衡常数始终不变,所以平衡常数不能判断是否达到平衡状态,故a错误;
b为物质的量随时间的变化,一氧化氮与二氧化碳浓度相等时,各组分浓度仍然继续变化,说明没有达到平衡状态,故b错误;
c为CO质量分数随时间变化,反应恰好总质量不变,则反应过程中一氧化氮与一氧化碳的物质的量之比会发生变化,当达到平衡状态时,一氧化氮与一氧化碳的物质的量之比不再变化,故c正确;
d、反应物的转化率不变,说明达平衡状态,故d正确;
故答案为:cd;
(4)0.1mol•L-1 NaOH溶液、0.1mol•L-1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L甲酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 mol•L-1甲酸溶液;根据图象中两线的起点可知,Ⅰ线甲酸溶液,Ⅱ线为盐酸溶液,甲酸和氢氧化钠之间的反应,当恰好完全反应得到的甲酸钠显示碱性,要使得溶液显示中性,pH=7,需要甲酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2;用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的甲酸反应,得到的是甲酸和甲酸钠的混合物,显示酸性,此时离子浓度大小c(HCOO-)>c (Na+)>c (H+)>c (OH-),
故答案为:甲酸溶液;<;c(HCOO-)>c (Na+)>c (H+)>c (OH-).
②平衡时能量变化放出29.4kJ,所以反应二氧化碳的物质的量为
| 29.4kJ |
| 49.0kJ |
| ||
| 10s |
(2)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
故答案为:小于;大于;
(3)当反应前后改变的物理量不变时,该可逆反应达到平衡状态,
a中为平衡常数,平衡常数与温度有关,温度不变,则平衡常数始终不变,所以平衡常数不能判断是否达到平衡状态,故a错误;
b为物质的量随时间的变化,一氧化氮与二氧化碳浓度相等时,各组分浓度仍然继续变化,说明没有达到平衡状态,故b错误;
c为CO质量分数随时间变化,反应恰好总质量不变,则反应过程中一氧化氮与一氧化碳的物质的量之比会发生变化,当达到平衡状态时,一氧化氮与一氧化碳的物质的量之比不再变化,故c正确;
d、反应物的转化率不变,说明达平衡状态,故d正确;
故答案为:cd;
(4)0.1mol•L-1 NaOH溶液、0.1mol•L-1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L甲酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 mol•L-1甲酸溶液;根据图象中两线的起点可知,Ⅰ线甲酸溶液,Ⅱ线为盐酸溶液,甲酸和氢氧化钠之间的反应,当恰好完全反应得到的甲酸钠显示碱性,要使得溶液显示中性,pH=7,需要甲酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2;用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的甲酸反应,得到的是甲酸和甲酸钠的混合物,显示酸性,此时离子浓度大小c(HCOO-)>c (Na+)>c (H+)>c (OH-),
故答案为:甲酸溶液;<;c(HCOO-)>c (Na+)>c (H+)>c (OH-).
看了 “C1化学”是指以碳单质或分...的网友还看了以下:
关于分布列和数学期望为拉动经济增长,某市决定新建一批重点工程,分别为基础设施工程、民生工程和产业建 2020-04-26 …
毕业后应该留在大城市还是会自己家的小城市?马上要找工作了在重庆上学过年要回家了不知道应该下学期回重 2020-05-17 …
公安工作是一个( )的系统。A.多种分工、多级层次B.双重分工、双层领导 C.多种分工、双层 2020-05-19 …
马克思主义政治经济学资本主义部分的理论基石是( )A.分工学说 B.货币学说 C.资本积累学 2020-06-05 …
统计学原理计算题1.我国国有独立核算工业企业的利税总额为1661亿元,轻工业、重工业利税分别为70 2020-06-14 …
24、某化工厂为综合利用FeSO4,设计了以下工艺流程:煅烧炉1中发生的部分化学反应有:(1)煤粉 2020-07-11 …
刘芳艳,荆门职业技术学院化工学院2010级计算机绘图专业宁夏籍学生。多年来,她勇敢地挑起家庭的重担, 2020-11-04 …
在学校卫生大扫除时,劳动委员总是这样分工:女同学负责擦玻璃等需要细心的活,男同学则主要负责拉车子打水 2020-12-01 …
2010年10月27日长沙新闻网报道:要高度重视哲学社会科学工作,把繁荣发展哲学社会科学摆上重要议事 2020-12-05 …
阅读下面的文字,完成下列各题(9分每小题3分)重建文学批评的公信力我们时代的文学现场和批评家的工作现 2020-12-10 …