早教吧作业答案频道 -->化学-->
“2015•8•12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.已知部分弱酸的电离平衡常数如下表:弱酸HCOOHHCNH2CO3电离平衡常数(25
题目详情
“2015•8•12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.已知部分弱酸的电离平衡常数如下表:
(1)根据价键规则,写出H2CO3的结构式___.
(2)下列能用于判断氮、碳两种元素非金属性强弱的是___(填序号)
a.气态氢化物的稳定性强弱 b.最高价氧化物对应水化物酸性强弱
c.Al2O3+N2+3C=2AlN+3CO d.比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因___. 请判断该溶液中:c(CN-) c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-.CNO-在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率.
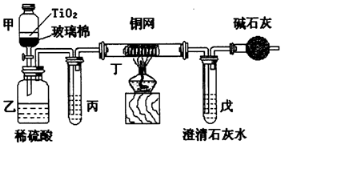
将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200ml倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞.
①甲中反应的离子方程式为___,乙中反应的离子方程式为___.
②上述实验是通过测定CO2的量来确定CN-的处理效果.若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是___,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为___.
(5)装置中碱石灰的作用是___.
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(2)下列能用于判断氮、碳两种元素非金属性强弱的是___(填序号)
a.气态氢化物的稳定性强弱 b.最高价氧化物对应水化物酸性强弱
c.Al2O3+N2+3C=2AlN+3CO d.比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因___. 请判断该溶液中:c(CN-) c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-.CNO-在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率.

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200ml倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞.
①甲中反应的离子方程式为___,乙中反应的离子方程式为___.
②上述实验是通过测定CO2的量来确定CN-的处理效果.若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是___,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为___.
(5)装置中碱石灰的作用是___.
▼优质解答
答案和解析
(1)碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,H2CO3中C能形成四个共价键,O能形成两个共价键,氢原子形成一个共价键,结构式为: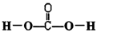 ,
,
故答案为: ;
;
(2)a.非金属性的强弱与气态氢化物稳定性有关,气态氢化物的稳定性越强非金属性越强,故a正确;
b.最高价氧化物对应水化物酸性强弱,越强非金属性越强,故b正确;
c.Al2O3+N2+3C═2AlN+3CO,反应中C为还原剂,N2为氧化剂,说明氮气氧化性大于碳单质,能说明非金属性强弱,故c正确;
d.在周期表中的位置,同周期从左到右非金属性增强,能说明,故d正确;
故答案为:abcd;
(3)0.01mol/L的NaCN溶液pH=9,溶液显碱性是因为CN-离子水解,呈碱性的原因离子方程式表示为:CN-+H2O⇌HCN+OH-,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CN-),c(H+)-),则c(Na+)>c(CN-),
故答案为:CN-+H2O⇌HCN+OH-;>;
(4)①CN-的废水在催化剂TiO2作用下用NaClO氧化,使CN-转化成CNO-,还生成氯离子,离子反应为CN-+ClO-═CNO-+Cl-,CNO-在酸性条件下继续被NaClO氧化成N2与CO2,还生成氯离子、水,离子反应为2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O,
故答案为;CN-+ClO-=CNO-+Cl-,2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O;
②乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,
故答案为:CN-+ClO-=CNO-+Cl-; 2CNO-+3ClO-+2H+=N2↑+2CO2↑+H2O+3Cl-;
②网能够和氯气反应从而除去氯气杂质,丁在实验中的作用是除去混合气体中Cl2,防止对CO2测定量的影响,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是HCl、Cl2,200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.009mol,反应的CN-的物质的量是0.009mol,CN-被处理的百分率是:
×100%=90%,
故答案为:HCl、Cl2;90%;
(5)装置戊是吸收生成的二氧化碳来称量质量得到碳元素物质的量,装置中碱石灰的作用是防止空气中的CO2进入戊,影响对产物的测定,
故答案为:防止空气中的CO2进入戊,影响对产物的测定;
 ,
,故答案为:
 ;
;(2)a.非金属性的强弱与气态氢化物稳定性有关,气态氢化物的稳定性越强非金属性越强,故a正确;
b.最高价氧化物对应水化物酸性强弱,越强非金属性越强,故b正确;
c.Al2O3+N2+3C═2AlN+3CO,反应中C为还原剂,N2为氧化剂,说明氮气氧化性大于碳单质,能说明非金属性强弱,故c正确;
d.在周期表中的位置,同周期从左到右非金属性增强,能说明,故d正确;
故答案为:abcd;
(3)0.01mol/L的NaCN溶液pH=9,溶液显碱性是因为CN-离子水解,呈碱性的原因离子方程式表示为:CN-+H2O⇌HCN+OH-,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CN-),c(H+)
故答案为:CN-+H2O⇌HCN+OH-;>;
(4)①CN-的废水在催化剂TiO2作用下用NaClO氧化,使CN-转化成CNO-,还生成氯离子,离子反应为CN-+ClO-═CNO-+Cl-,CNO-在酸性条件下继续被NaClO氧化成N2与CO2,还生成氯离子、水,离子反应为2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O,
故答案为;CN-+ClO-=CNO-+Cl-,2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O;
②乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,
故答案为:CN-+ClO-=CNO-+Cl-; 2CNO-+3ClO-+2H+=N2↑+2CO2↑+H2O+3Cl-;
②网能够和氯气反应从而除去氯气杂质,丁在实验中的作用是除去混合气体中Cl2,防止对CO2测定量的影响,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是HCl、Cl2,200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.009mol,反应的CN-的物质的量是0.009mol,CN-被处理的百分率是:
| 0.009mol |
| 0.01mol |
故答案为:HCl、Cl2;90%;
(5)装置戊是吸收生成的二氧化碳来称量质量得到碳元素物质的量,装置中碱石灰的作用是防止空气中的CO2进入戊,影响对产物的测定,
故答案为:防止空气中的CO2进入戊,影响对产物的测定;
看了 “2015•8•12”天津港...的网友还看了以下:
已知关于X的一元二次方程x^2+2(k-1)x+k^2-1=0有两个不相等的实数根已知关于x的一元 2020-05-16 …
先阅读,设a、b是有理数,且满足a+√2▔·b=3-2√2▔,求b的a次方的值.由题意得(a-3) 2020-06-14 …
10本不同的书按2∶2∶2∶4分给甲、乙、丙、丁四个人有多少种不同的分法?找到如下条案:1、甲从1 2020-06-15 …
怪数学题6=2×3因数是1,2,3,6共有4个12=2×2×3=2²×3¹,因数是1,2,3,4, 2020-06-22 …
2.2千W深水泵三相电流不平衡A相3.0A,B相3.9.A,C相2.9A,不知道对水泵有没有影响? 2020-06-29 …
2.2千W深水泵三相电流不平衡A相3.0A,B相3.9.A,C相2.9A,不知道对水泵有没有影响? 2020-06-29 …
3水与水蒸气达汽液两相平衡时的自由度数f为().A.0B.1C.2D.34、理想气体反应体系,该反 2020-07-10 …
48=2*2*2*2*384=2*2*3*748和84全部共有的质因数是(1)36和60的共有质因 2020-07-31 …
下列语句:①2+2是有理数;②求方程x2+2x-3=0的解;③2100是个大数;④肺炎是怎样传播的 2020-08-02 …
(x-2)^2=9(x+3)(步骤)用十字相乘法:x^2-5倍的根号2*x+83x^2-2x-1= 2020-08-03 …