早教吧作业答案频道 -->化学-->
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:(1)反应①应在温度较低的情况下进行.因在温度较高时KOH与Cl2反应生成的是KClO3.写出在
题目详情
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:
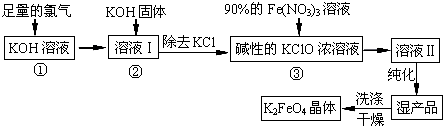
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.写出在温度较高时KOH 与Cl2反应的化学方程式___,当反应中转移5mol电子时,消耗的氯气是___mol.
(2)在反应液I中加入KOH固体的目的是___(填编号).
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,它们都是重要的化工产品,具体说出其中一种物质的用途___.写出反应③中发生的离子反应方程式为___.
(4)如何判断K2FeO4晶体已经洗涤干净___.K2FeO4具有强氧化性的原因___.
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:___FeO42¯+___H2O=___Fe(OH)3(胶体)+___O2↑+___
完成并配平上述反应的离子方程式.

(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.写出在温度较高时KOH 与Cl2反应的化学方程式___,当反应中转移5mol电子时,消耗的氯气是___mol.
(2)在反应液I中加入KOH固体的目的是___(填编号).
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,它们都是重要的化工产品,具体说出其中一种物质的用途___.写出反应③中发生的离子反应方程式为___.
(4)如何判断K2FeO4晶体已经洗涤干净___.K2FeO4具有强氧化性的原因___.
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:___FeO42¯+___H2O=___Fe(OH)3(胶体)+___O2↑+___
完成并配平上述反应的离子方程式.
▼优质解答
答案和解析
足量氯气通入KOH溶液中低温反应生成KClO、KCl和水,加入固体KOH,KOH能和过量的氯气反应生成KClO且为下一步提供碱性环境,加入硝酸铁浓溶液纯化得到高铁酸钾,然后洗涤干燥得到高铁酸钾固体;
(1)温度较高时,氯气和KOH反应生成KCl、KClO3和水;该反应中Cl元素化合价由0价转化为-1价、+5价,转移电子数为5,反应方程式为6KOH+3Cl2
KClO3+5KCl+3H2O,
该反应中如果消耗3mol氯气,则转移5mol电子,所以当转移5mol电子时消耗3mol氯气,消耗的氯气在标准状况下的体积约为=3mol×22.4L/mol=67.2L
故答案为:6KOH+3Cl2
KClO3+5KCl+3H2O;67.2;
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为KClO,化合价只降不升,故D错误;
故选:AC;
(3)硝酸钾能作化肥和炸药;
据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:硝酸钾作化肥和炸药;2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净;高铁酸钾中Fe元素处于最高价态,能得电子而作强氧化剂,
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净;高铁酸钾中Fe元素处于最高价态,只能得电子而具有强氧化性;
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:
4;10;4;3;8OH-.
(1)温度较高时,氯气和KOH反应生成KCl、KClO3和水;该反应中Cl元素化合价由0价转化为-1价、+5价,转移电子数为5,反应方程式为6KOH+3Cl2
| ||
该反应中如果消耗3mol氯气,则转移5mol电子,所以当转移5mol电子时消耗3mol氯气,消耗的氯气在标准状况下的体积约为=3mol×22.4L/mol=67.2L
故答案为:6KOH+3Cl2
| ||
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为KClO,化合价只降不升,故D错误;
故选:AC;
(3)硝酸钾能作化肥和炸药;
据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:硝酸钾作化肥和炸药;2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净;高铁酸钾中Fe元素处于最高价态,能得电子而作强氧化剂,
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净;高铁酸钾中Fe元素处于最高价态,只能得电子而具有强氧化性;
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:
4;10;4;3;8OH-.
看了 高铁酸钾(K2FeO4)是一...的网友还看了以下:
人的口腔上皮细胞构成的结构属于生物体结构层次中的()A个体B系统C器官D组织下列关于细胞大小的叙述 2020-05-02 …
关于我国土地资源的叙述,正确的是A.耕地,林地比重偏小B.荒地多,后备土地资源多C.土地资源关于我 2020-06-07 …
已知:0°C时等于32°F,100°C时等于212°F.求20°C时等于多少°F,90°F等于多少 2020-06-12 …
金石滩龟背石形成于多少年前的地球什么时期5.4亿年前的寒武纪是我们这颗星球的青春期 2020-06-18 …
cba减去abc再减去aaa等于87,a等于多少,b等于多’c等于多少? 2020-07-17 …
A、B、C、D能组成多少种不一样的?就是类似于A.C.B.DA.D.B.CA.D.C.B或者B开头 2020-07-25 …
二十二道π的数学口算题和一道圆的应用题1;c等于3.14d等于多少2;C等于6.28d等于多少3; 2020-07-31 …
将2,4和8在配上一个数组成比例有几种方法?A,B,C,D都不等于0,且AC=BD那么D分之A=多 2020-08-02 …
胰高血糖素的生理作用应该是A.提高心肌的兴奋性B.促进脂肪分解,使酮体生成增多C.促进糖原分解,抑制 2020-10-30 …
胰高血糖素的生理作用应该是:A.提高心肌的兴奋性B.促进脂肪分解,使酮体生成增多C.促进糖原分解,抑 2020-10-30 …