以硼镁矿(2Mg·B2O3·H2O·SiO2)及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:(1)由于矿粉中含CaCO3,“浸取”时容易
以硼镁矿 (2Mg·B 2 O 3 ·H 2 O·SiO 2 ) 及少量 Fe 3 O 4 、 CaCO 3 、 Al 2 O 3 ) 为原料生产硼酸的工艺流程如下:
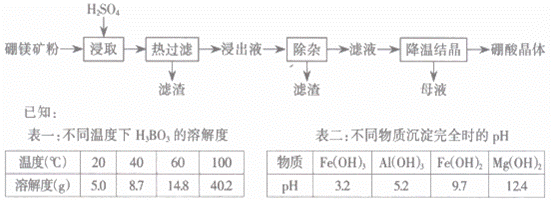
(1) 由于矿粉中含 CaCO 3 , “ 浸取 ” 时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为 _____ 。
(2) “ 浸出液 ” 显酸性,含有 H 3 BO 3 、 Mg 2 + 和 ![]() ,还含有 Fe 2 + 、 Fe 3 + 、 Ca 2 + 、 Al 3 + 等杂质。 “ 除杂 ” 时,向浸出液中依次加入适量目 H 2 O 2 和 MgO ,可以除去的杂质离子为 _________ , H 2 O 2 的作用为 _________( 用离子方程式表示 ) 。
,还含有 Fe 2 + 、 Fe 3 + 、 Ca 2 + 、 Al 3 + 等杂质。 “ 除杂 ” 时,向浸出液中依次加入适量目 H 2 O 2 和 MgO ,可以除去的杂质离子为 _________ , H 2 O 2 的作用为 _________( 用离子方程式表示 ) 。
(3) “ 浸取 ” 后,采用 “ 热过滤 ” 的目的为 _______ 。
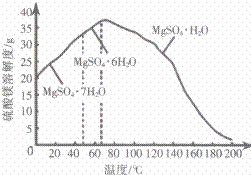
(4) “ 母液 ” 可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从 “ 母液 ” 中充分回收 MgSO 4 ·H 2 O ,应采取的措施是将 “ 母液 ” 蒸发浓缩, ____ 。
(5) 已知 25 ℃时,硼酸 ( H 3 BO 3 ) 溶液中存在如下平衡:
H 3 BO 3 (aq) + H 2 O(l) ![]() [B(OH) 4 ] - (aq) + H + (aq) K =5.7×10 - 10 ;
[B(OH) 4 ] - (aq) + H + (aq) K =5.7×10 - 10 ;
25 ℃ 时, 0.7 mol·L - 1 硼酸溶液中 c (H + )≈mol·L - 1 。
(6) 已知 25 ℃时:
| 化学式 | H 2 CO 3 | CH 3 COOH |
| 电离常数 | K 1 =4.4×10 - 7 K 2 =4.7×10 - 11 | K =1.75×10 - 5 |
下列说法正确的是 _____________( 填选项字母 ) 。
A. 碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B. 碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C. 等浓度碳酸溶液和硼酸溶液的 pH :前者>后者
D. 等浓度碳酸钠溶液和醋酸钠溶液的 pH :前者>后者
【答案】 (1) 分批慢慢加入硫酸 ( 或边加入边搅拌 )
(2)Fe 3 + 、 Fe 2 + 、 Al 3 + ; 2Fe 2 + + 2H + + H 2 O 2 ![]() 2Fe 3 + + 2H 2 O
2Fe 3 + + 2H 2 O
(3) 防止因温度下降时 H 3 BO 3 从溶液中析出
(4) 加压升温结晶 ( 或加压升温结晶过滤 )
(5)2×10 - 5
(6)BD
【解析】本题考查了工业生产硼酸的工艺流程分析及有关问题。 (1) 浸取矿粉时,矿粉中含有石灰石,如果一次加入硫酸,会导致碳酸钙分解产生大量气泡,为防止大量气泡产生,可以控制加入硫酸的量来控制反应,故可以分批慢慢加入硫酸。 (2) 由于铁离子和铝离子能够水解,即 Fe 3+ +3H 2 O ![]() Fe(OH) 3 +3H + 、 Al 3+ +3H 2 O
Fe(OH) 3 +3H + 、 Al 3+ +3H 2 O ![]() Al(OH) 3 +3H + ,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即 MgO+2H +
Al(OH) 3 +3H + ,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即 MgO+2H + ![]() Mg 2+ +H 2 O ,减小氢离子浓度,增大溶液 pH 至 3.2 时,促进铁离子水解彻底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液 pH 至 5.2 时,促进铝离子水解彻底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是 Fe 3+ 、 Fe 2+ 、 Al 3+ 。双氧水是常用的绿色氧化剂,所含氧元素由- 1 价降低为- 2 价,杂质阳离子中只有亚铁离子能被其氧化为铁离子,根据化合价升降,电荷守恒、质量守恒可得离子方程式为 H 2 O 2 +2H + +2Fe 2+
Mg 2+ +H 2 O ,减小氢离子浓度,增大溶液 pH 至 3.2 时,促进铁离子水解彻底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液 pH 至 5.2 时,促进铝离子水解彻底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是 Fe 3+ 、 Fe 2+ 、 Al 3+ 。双氧水是常用的绿色氧化剂,所含氧元素由- 1 价降低为- 2 价,杂质阳离子中只有亚铁离子能被其氧化为铁离子,根据化合价升降,电荷守恒、质量守恒可得离子方程式为 H 2 O 2 +2H + +2Fe 2+ ![]() 2Fe 3+ +2H 2 O 。 (3) 浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息, H 3 BO 3 在 20 ℃、 40 ℃、 60 ℃、 100 ℃时的溶解度依次为 5.0g 、 8.7g 、 14.8g 、 40.2g ,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时 H 3 BO 3 从溶液中析出。 (4) 除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从 “ 母液 ” 中充分回收 MgSO 4 •H 2 O ,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是 MgSO 4 •7H 2 O 晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到 MgSO 4 •H 2 O 晶体。 (5)25 ℃ 时, 0.7 mol·L - 1 硼酸溶液中 c (H + )=
2Fe 3+ +2H 2 O 。 (3) 浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息, H 3 BO 3 在 20 ℃、 40 ℃、 60 ℃、 100 ℃时的溶解度依次为 5.0g 、 8.7g 、 14.8g 、 40.2g ,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时 H 3 BO 3 从溶液中析出。 (4) 除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从 “ 母液 ” 中充分回收 MgSO 4 •H 2 O ,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是 MgSO 4 •7H 2 O 晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到 MgSO 4 •H 2 O 晶体。 (5)25 ℃ 时, 0.7 mol·L - 1 硼酸溶液中 c (H + )= ![]() =
= ![]() =2×10 - 5 mol/L 。 (6) 根据平衡常数可知,酸性为 H 2 CO 3 H 3 BO 3
=2×10 - 5 mol/L 。 (6) 根据平衡常数可知,酸性为 H 2 CO 3 H 3 BO 3 ![]() ,所以碳酸钠溶液滴入硼酸溶液中不能观察到有气泡产生,故 A 错。根据平衡常数可知,酸性 CH 3 COOHH 3 CO 3 ,则碳酸钠溶液滴入醋酸溶液可生成二氧化碳气体,所以能观察到有气泡产生,故 B 正确。根据平衡常数可知,酸性 H 2 CO 3 H 3 BO 3 ,所以碳酸的电离常数大于硼酸,等浓度碳酸溶液和硼酸溶液比较,酸性碳酸大于硼酸, pH :前者小于后者,故 C 错。根据平衡常数可知,酸性 CH 3 COOHH 3 CO 3 ,所以碳酸根离子的水解程度大于醋酸根离子的水解程度,则等浓度碳酸钠溶液和醋酸钠溶液的 pH :前者>后者,故 D 正确。
,所以碳酸钠溶液滴入硼酸溶液中不能观察到有气泡产生,故 A 错。根据平衡常数可知,酸性 CH 3 COOHH 3 CO 3 ,则碳酸钠溶液滴入醋酸溶液可生成二氧化碳气体,所以能观察到有气泡产生,故 B 正确。根据平衡常数可知,酸性 H 2 CO 3 H 3 BO 3 ,所以碳酸的电离常数大于硼酸,等浓度碳酸溶液和硼酸溶液比较,酸性碳酸大于硼酸, pH :前者小于后者,故 C 错。根据平衡常数可知,酸性 CH 3 COOHH 3 CO 3 ,所以碳酸根离子的水解程度大于醋酸根离子的水解程度,则等浓度碳酸钠溶液和醋酸钠溶液的 pH :前者>后者,故 D 正确。
1.(初一上的)今天我们才学去分母可是有道题不去也可以做去了也可以做到底杂半捏题目是这样的:解下列 2020-05-14 …
解方程4-3(x-1)=x+10 7(m+1)=12-5(m+1) 2020-05-16 …
解方程4-3(20-y)=6y-7(12-y) 2020-05-17 …
1、矿物2、原生矿物3、次生矿物4、条痕5、解理6、岩浆岩的结构 2020-05-20 …
一道带根号的方程4/3=x/根号(9-X平方) 2020-06-12 …
14.86式152毫米加农炮是我国自行设计的第一种大口远射程加农炮,该炮最大射程17.3公里,最小 2020-06-25 …
张叔叔做一项工程,4/3小时完成了这项工程的8/5.完成这项工程要多少小时. 2020-07-12 …
张叔叔做一项工程,4/3小时完成了这项工程的8/5.完成这项工程要多少小时? 2020-07-12 …
某矿厂有3台挖掘机,2.6小时共挖了179.4吨矿石,平均每台挖掘机每小时挖多少吨矿石? 2020-07-18 …
下面几种"水"1,自来水2,矿泉水3,井水4,雨其中属于纯净物的是?下面几种“水”1、自来水2、矿泉 2020-11-20 …