已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka1;HC2O4-═C2O42-+H+Ka2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ
已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )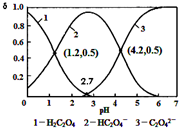
A. 常温下,Ka 1:Ka 2=1000
B. 将相同物质的量 KHC2O4 和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液
C. pH=1.2 溶液中:c(K +)+c(H + )=c(OH-)+c(H2C2O4)
D. 向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
| Ka1 |
| Ka2 |
c2(HC2
| ||
c(H2C2O4)•c(C2
|
B、将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故B错误;
C、pH=1.2时,H2C2O4、HC2O4-的物质的量分数相等,且c(K+)+c(H+)=c(OH-)+c(HC2O4-),则c(K+)+c(H+)=c(OH-)+c(H2C2O4),故C正确;
D、向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,故D正确.
故选B.
物质的摩尔质量.1.2.5mol的Ba(oh)2中含有( )个Ba2+,含有___个Oh-,2.5 2020-05-13 …
如何求化合物中各元素的质量比计算H O两种元素的质量比1.查处H O两种元素的质量 H:1 O:1 2020-05-16 …
利用Na+1价K0价H+1价O-2价C[+4价]N[O价]组成以下物质1.酸2.碱3盐 2020-05-24 …
H+1,O-2,C+2,S+6,Ca+2(+1-2+2+6+2都标在上面)在这5种元素中选择适当元 2020-06-04 …
若秤砣的质量为0.5kg,秤钩悬挂处A与秤纽O的距离为8cm,挂上重物后,秤砣移至距O点32cm的 2020-06-21 …
化学反应的微观实质①过氧化氢在二氧化锰作催化剂的条件下的化学反应微观实质②贡在加热的条件下的化学反 2020-06-24 …
化学物质的比例就等于其下标数吗?比如:C:O=1:2.所以就是CO2?关于化学上,算出一种物质C: 2020-07-09 …
一列简谐横波在介质中沿x轴正向传播,波长不小于10cm.O和A是介质中平衡位置分别位于x=0和x= 2020-07-19 …
求给以下算法复杂度排序增长速度由慢到快1)O(n^(3/4))O(log(n)^5)O(2^n)O 2020-07-23 …
苹果酸钠的化学式为:C4H5O5Na.请回答下列问题:(1)苹果酸钠盐的相对分子质量是.(2)苹果 2020-07-29 …