早教吧作业答案频道 -->化学-->
已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业.(1)已知25℃时,几种常见弱酸的Ka如下表所示:电解质H2C2O4CH3COOHHCNH2CO3电离常数(mol
题目详情
已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业.
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
①25℃时,浓度均为0.1mol•L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是___.中和等体积、等pH的HCOOH和HCN消耗NaOH的量___(填“前者大”“后者大”或“相等”).
②下列关于0.1mol•L‑1NaHC2O4溶液的说法正确的是___.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是___.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)⇌Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)
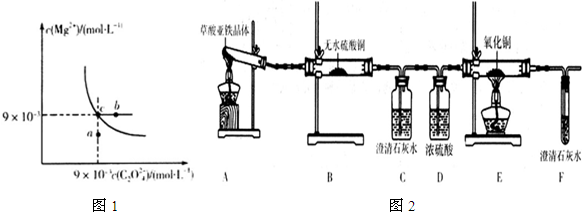
(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是___.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃___(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,___.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为___.草酸亚铁晶体分解的化学方程式为___.
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol•L‑1NaHC2O4溶液的说法正确的是___.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是___.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)⇌Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是___.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃___(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,___.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为___.草酸亚铁晶体分解的化学方程式为___.
▼优质解答
答案和解析
(1)①电离常数越大,酸的酸性越强,其盐溶液的水解程度越小,盐溶液的pH越小,则浓度均为0.1mol•L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是Na2CO3>NaCN>CH3COONa>Na2C2O4;pH相同时,酸性越强,其酸的浓度越小,已知甲酸的酸性大于HCN,则pH相同时HCN的浓度大,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量,HCN消耗的氢氧化钠多;
故答案为:Na2CO3>NaCN>CH3COONa>Na2C2O4;后者大;
②a.已知K2=
=5.4×10-3,则HC2O4-溶液显酸性,则HC2O4-的电离程度大于水解程度,溶液显酸性,故a正确;
b.HC2O4-的电离程度大于水解程度,溶液显酸性,故b错误;
c.NaHC2O4溶液存在电荷守恒,则溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故c错误;
d.NaHC2O4溶液存在电荷守恒为c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),物料守恒为,c(Na+)=c(HC2O4-)++c(C2O42-)+c(H2C2O4),联立两个式子可得:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4),故d正确;
故答案为:ad;
(2)A.MgC2O4的Ksp=c(Mg2+)×c(C2O42-)=(9×10-3)2=8.1×10-5(mol•L-1),故A正确;
B.在MgC2O4饱和溶液中加入Na2CO3固体,会生成碳酸镁沉淀,则镁离子浓度减小,图中由c点到b点时镁离子浓度不变,故B错误;
C.沉淀溶解平衡曲线下面的点代表不饱和溶液,则a点对应的是MgC2O4的不饱和溶液,故C正确;
D.MgC2O4 (s)+2OH-(aq)⇌Mg(OH)2(s)+C2O42-(aq)平衡常数K=
=
,故D错误;
故答案为:BD;
(3)①CO属于有毒气体,要进行尾气处理,所以从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置;
故答案为:缺少尾气处理装置;
②可燃性气体与氧气混合达到一定程度时,遇明火会发生爆炸,所以先点燃分解反应处的酒精灯,排尽装置中的空气,即先点燃A处的酒精灯;
故答案为:A;
③实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色固体变红色,则可证明草酸亚铁晶体热分解的气体产物是H2O,CO,CO2;
故答案为:C中澄清石灰水变浑浊,E中黑色粉末变红色;
④草酸亚铁晶体中的铁元素质量为:3.6g×
=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,
氧化物中氧元素的质量为:1.60g-1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则有:56x:16y=7:3,
x:y=2:3,
所以铁的氧化物的化学式为Fe2O3;
则草酸亚铁晶体分解生成的产物为Fe2O3、H2O、CO、CO2,其反应方程式为:FeC2O4•2H2O
Fe2O3+3CO↑+CO2↑+2H2O;
故答案为:Fe2O3;FeC2O4•2H2O
Fe2O3+3CO↑+CO2↑+2H2O.
故答案为:Na2CO3>NaCN>CH3COONa>Na2C2O4;后者大;
②a.已知K2=
| c(C2O42-)×c(H+) |
| c(HC2O4-) |
b.HC2O4-的电离程度大于水解程度,溶液显酸性,故b错误;
c.NaHC2O4溶液存在电荷守恒,则溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故c错误;
d.NaHC2O4溶液存在电荷守恒为c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),物料守恒为,c(Na+)=c(HC2O4-)++c(C2O42-)+c(H2C2O4),联立两个式子可得:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4),故d正确;
故答案为:ad;
(2)A.MgC2O4的Ksp=c(Mg2+)×c(C2O42-)=(9×10-3)2=8.1×10-5(mol•L-1),故A正确;
B.在MgC2O4饱和溶液中加入Na2CO3固体,会生成碳酸镁沉淀,则镁离子浓度减小,图中由c点到b点时镁离子浓度不变,故B错误;
C.沉淀溶解平衡曲线下面的点代表不饱和溶液,则a点对应的是MgC2O4的不饱和溶液,故C正确;
D.MgC2O4 (s)+2OH-(aq)⇌Mg(OH)2(s)+C2O42-(aq)平衡常数K=
| c(C2O42-) |
| c2(OH-) |
| Ksp[MgC2O4] |
| Ksp[Mg(OH)2] |
故答案为:BD;
(3)①CO属于有毒气体,要进行尾气处理,所以从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置;
故答案为:缺少尾气处理装置;
②可燃性气体与氧气混合达到一定程度时,遇明火会发生爆炸,所以先点燃分解反应处的酒精灯,排尽装置中的空气,即先点燃A处的酒精灯;
故答案为:A;
③实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色固体变红色,则可证明草酸亚铁晶体热分解的气体产物是H2O,CO,CO2;
故答案为:C中澄清石灰水变浑浊,E中黑色粉末变红色;
④草酸亚铁晶体中的铁元素质量为:3.6g×
| 56 |
| 180 |
氧化物中氧元素的质量为:1.60g-1.12g=0.48g,
铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则有:56x:16y=7:3,
x:y=2:3,
所以铁的氧化物的化学式为Fe2O3;
则草酸亚铁晶体分解生成的产物为Fe2O3、H2O、CO、CO2,其反应方程式为:FeC2O4•2H2O
| ||
故答案为:Fe2O3;FeC2O4•2H2O
| ||
看了 已知草酸(H2C2O4)是一...的网友还看了以下:
点E是矩形ABCD的DC边上任意一点,AE的延长线交BC的延长线于点F,直线BE交△CEF外接圆⊙ 2020-05-13 …
如图,AB是⊙O的直径,C是AB的中点,⊙O的切线BD交AC的延长线于点D,E是OB的中点,CE的 2020-06-15 …
如图,AB是圆O直径,C是弧AB的中点,圆O的切线BD交AC延长线与点D,E是OB的中点,CE延长 2020-06-15 …
(2003•滨州)如图,过圆心O的割线PAB交⊙O于A、B,PC切⊙O于C,弦CD⊥AB于点H,点 2020-06-15 …
(2003•温州)如图1,点A在⊙O外,射线AO交⊙O于F,C两点,点H在⊙O上,=2,D是上的一 2020-07-19 …
如图,AB是O的直径,C是弧AB的中点,连接AC并延长至D,使DC=CA,连接DB,点E为OB的中 2020-07-21 …
已知,如图,O是△ABC的外接圆,OD⊥BC交O于点D,CE平分∠ACB交AB于点E,交O于点H, 2020-07-22 …
(2014•北京)如图,AB是⊙O的直径,C是AB的中点,⊙O的切线BD交AC的延长线于点D,E是 2020-07-24 …
一道关于圆的题目,已知BC是圆O的直径D为直径BC上一动点(不与B,O,C重合)过点D作AH⊥BC 2020-07-26 …
⊿ABC的三个顶点都在⊙O上,AD,BE是高,交点为H,BE的延长线交⊙O于F,下列结论:⊿ABC的 2020-12-23 …