早教吧作业答案频道 -->化学-->
某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如图1实验:已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质.(1)①中的白色沉淀是.(2)分离
题目详情
某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如图1实验:
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质.
(1)①中的白色沉淀是___.
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化___.
(3)②中可能发生的离子反应有___.
(4)实验①的设计目的___.
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为___.
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验(如图2):
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变.
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如图3实验:
现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化.
丙同学的设计在证明氧化还原反应的优点是___.
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是___.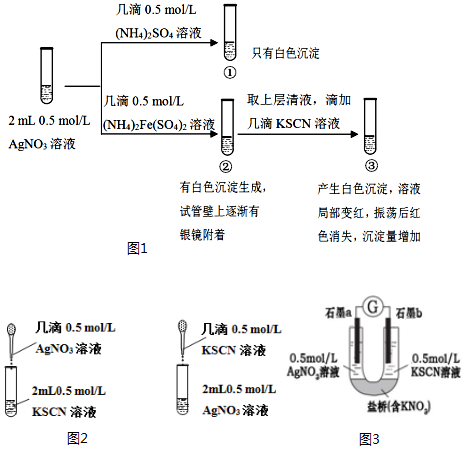
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质.
(1)①中的白色沉淀是___.
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化___.
(3)②中可能发生的离子反应有___.
(4)实验①的设计目的___.
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为___.
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验(如图2):
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变.
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如图3实验:
现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化.
丙同学的设计在证明氧化还原反应的优点是___.
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是___.

▼优质解答
答案和解析
(1)硝酸银溶液中滴入硫酸铵,生成白色沉淀为硫酸银,化学式为:Ag2SO4,
故答案为:Ag2SO4;
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,是硫酸银转化为AgI,发生的是沉淀转化,反应的离子方程式为:Ag2SO4(s)+2 I-═2Ag I(s)+SO42-,
故答案为:Ag2SO4(s)+2 I-═2Ag I(s)+SO42-;
(3)②中硝酸银溶液中滴入硫酸亚铁铵,有白色沉淀生成是生成的硫酸银,反应的离子方程式为:2Ag++SO42-═Ag2SO4,试管壁有银析出,可能发生的离子反应是银离子氧化亚铁离子为铁离子,本身被还原为银,反应的离子方程式为:Ag++Fe2+═Ag+Fe3+,
故答案为:2Ag++SO42-═Ag2SO4,Ag++Fe2+═Ag+Fe3+;
(4)实验①的设计目的是探究②中白色沉淀的来源,排除②中铵根的影响,
故答案为:探究②中白色沉淀的来源,排除②中铵根的影响;
(5)Ⅰ.取上层清液,滴加KSCN溶液,产生白色沉淀溶液变红色,振荡后红色褪去,沉淀量增加,红色褪去的原因与平衡移动原理有关局部溶液发生反应Fe3++3SCN-=Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色,
故答案为:局部溶液发生反应Fe3++3SCN-=Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色;
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如图3实验现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化,丙同学的设计在证明氧化还原反应的优点是避免氧化性、还原性离子直接接触,发生沉淀反应引起离子浓度的降低,导致离子氧化性、还原性减弱,
故答案为:避免氧化性、还原性离子直接接触,发生沉淀反应引起离子浓度的降低,导致离子氧化性、还原性减弱;
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论,是硝酸银与不同盐反应的类型与构成盐的阴阳离子的种类、离子浓度、反应条件等有关,
故答案为:硝酸银与不同盐反应的类型(沉淀或氧化还原),与构成盐的阴阳离子的种类、离子浓度、反应条件等有关.
故答案为:Ag2SO4;
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,是硫酸银转化为AgI,发生的是沉淀转化,反应的离子方程式为:Ag2SO4(s)+2 I-═2Ag I(s)+SO42-,
故答案为:Ag2SO4(s)+2 I-═2Ag I(s)+SO42-;
(3)②中硝酸银溶液中滴入硫酸亚铁铵,有白色沉淀生成是生成的硫酸银,反应的离子方程式为:2Ag++SO42-═Ag2SO4,试管壁有银析出,可能发生的离子反应是银离子氧化亚铁离子为铁离子,本身被还原为银,反应的离子方程式为:Ag++Fe2+═Ag+Fe3+,
故答案为:2Ag++SO42-═Ag2SO4,Ag++Fe2+═Ag+Fe3+;
(4)实验①的设计目的是探究②中白色沉淀的来源,排除②中铵根的影响,
故答案为:探究②中白色沉淀的来源,排除②中铵根的影响;
(5)Ⅰ.取上层清液,滴加KSCN溶液,产生白色沉淀溶液变红色,振荡后红色褪去,沉淀量增加,红色褪去的原因与平衡移动原理有关局部溶液发生反应Fe3++3SCN-=Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色,
故答案为:局部溶液发生反应Fe3++3SCN-=Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色;
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如图3实验现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化,丙同学的设计在证明氧化还原反应的优点是避免氧化性、还原性离子直接接触,发生沉淀反应引起离子浓度的降低,导致离子氧化性、还原性减弱,
故答案为:避免氧化性、还原性离子直接接触,发生沉淀反应引起离子浓度的降低,导致离子氧化性、还原性减弱;
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论,是硝酸银与不同盐反应的类型与构成盐的阴阳离子的种类、离子浓度、反应条件等有关,
故答案为:硝酸银与不同盐反应的类型(沉淀或氧化还原),与构成盐的阴阳离子的种类、离子浓度、反应条件等有关.
看了 某小组为探究AgNO3溶液和...的网友还看了以下:
08年广东 69.人体内胆固醇可以转化为A.生长激素 B.甲状腺素C.胰岛素 D.维生素D70.黑 2020-05-16 …
硫氰的化学式为(SCN)2,结构式为N≡C-S-S-C≡N,其分子及阴离子(SCN-)的性质都与卤 2020-06-18 …
通过纸层析法分离叶绿体色素,结果在滤纸条上出现四条色素带,自上而下依次为()A.胡萝卜素、叶黄素、 2020-06-26 …
(2011•扬州)维生素A(C20H30O)能维持人体正常的视觉反应,下列说法正确的是()A.维生 2020-07-19 …
维生素A(C20H30O)能维持人体正常的视觉反应,下列说法正确的是[]A.维生素A的相对分子质量 2020-07-19 …
素食者无法从食物中摄取仅存于肉类中的维生素A,但是,果蔬中的()被摄入后,也能在人体内转变为维生素A 2020-10-29 …
有A、B、C、D四种元素,A是空气中含量最多的元素,B是地壳中含量最多的元素,C是人类向自然界提取量 2020-10-31 …
关于叶绿体色素的叙述,错误的是()A.叶绿素a和叶绿素b都含有镁元素B.叶绿素a和叶绿素b在红光区的 2020-11-02 …
用层析法分离叶绿体色素的实验中,所得4条色素带中相距最远的两种色素是()A.胡萝卜素与叶黄素B.叶黄 2020-11-10 …
(2013•焦作模拟)“河南粮农为全国人民撑腰!”小麦中富含淀粉、蛋白质、脂肪、钙、铁及维生素A等. 2020-11-12 …