用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是()A.该Na2CO3溶液的浓度为0.001mol/LB.pH=6时
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )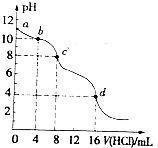
A. 该Na2CO3溶液的浓度为0.001mol/L
B. pH=6时,c(Na+)>c(HCO3-)>c(CO32-)
C. 在pH=7时,c(Na+)=c(Cl-)
D. c→d发生的主要离子反应为:CO32-+H+=HCO3-
B、在pH=6时,溶液显酸性,溶液的组成是:碳酸氢钠和碳酸钠溶液的混合物,故此时c(Na+)>c(HCO3-)>c(CO32-),故B正确;
C、在pH=7时,溶液显示中性,氢离子和氢氧根离子浓度相等,此时溶液中还含有碳酸根离子和碳酸氢根离子,所以钠离子大于氯离子浓度,故C错误;
D、根据pH变化曲线,可以看出c到d阶段,随着盐酸的加入,pH不再变化,所以该阶段盐酸剩余,碳酸钠和碳酸氢钠完全消耗掉了,故D错误.
故选B.
某次考试,A.B.C.D四人的成绩如下:A.B.C平均分:91分B.C.D平均分:89分A.D平均 2020-05-20 …
有机物A含C、H、O三种元素,A可与Na作用产生H2,A在催化剂作用下与苯甲酸酯化得相对分子质量为 2020-06-07 …
2004年考研数一第八题,原题:设函数f(x)连续,且f’(0)>0,则存在δ>0,使得选(C)( 2020-06-11 …
设a>c,b>c,c>0,证明不等式根号下c(a-c)+根号下c(b-c)≤根号下ab 2020-06-12 …
条件概率问题,已知P(A),P(B|A),P(C|A),能否求得P(C|A,B)?写错了,是已知P 2020-06-13 …
长320宽160可以画成椭圆吗怎样画的描述下.c=√(a^2-b^2)=80√3 2020-06-21 …
解直角三角形问题sinA=a除以c,怎么求角A?比如下面这道书上的例题我有个地方不明白:在Rt△A 2020-07-04 …
111abca2b2c2这个3阶行列式我怎么用对角线法和范德蒙德行列式法算出来不一样啊,求两种解法 2020-07-09 …
有机推断题化合物A,分子式为C4H6O4,加热后得到分子式为C4H4O3的B,将A与过量甲醇及少量 2020-07-09 …
(1)、化合物A,分子式为C4H6O4.加热后的分子式为C4H4○3的B,将A与过量甲醇及少量硫酸 2020-07-09 …