早教吧作业答案频道 -->化学-->
聚合硫酸铁([Fe2(OH)n(SO4)(3-0.5n)]m,n≥2,m≤10)简称聚铁,是一种高效的絮凝剂.某中学学习小组欲测定硫酸亚铁样品溶液中铁元素总量,并用硫酸亚铁制备聚合硫酸铁,设计的实
题目详情
聚合硫酸铁([Fe2(OH)n(SO4)(3-0.5n)]m,n≥2,m≤10)简称聚铁,是一种高效的絮凝剂.某中学学习小组欲测定硫酸亚铁样品溶液中铁元素总量,并用硫酸亚铁制备聚合硫酸铁,设计的实验过程如下:
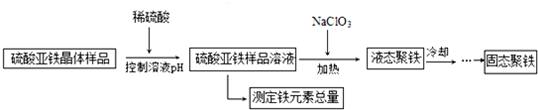
请回答下列问题:
(1)实验需要大约100mL的1:9硫酸(浓硫酸与溶剂水的体积比),配制该硫酸时需要的玻璃仪器是:玻璃棒、___,配制过程是___.
(2)限用以下试剂:蒸馏水、稀硫酸、KSCN溶液、K3[Fe(CN)6]溶液、新制氯水
某同学通过实验判断硫酸亚铁晶体已部分变质,他设计的实验是:将硫酸亚铁晶体溶于稀硫酸中,加少量水稀释,___(请将操作、现象、结论补充完整).
(3)上述过程制得某种聚铁[Fe2(OH)4SO4]4的化学方程式是___.
(4)测定硫酸亚铁样品溶液中铁元素总量的实验如下:准确量取5.00mL溶液放入带塞的锥形瓶中,加入足量H2O2,加热煮沸一定时间,加入过量KI,充分反应后,再用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
提示:2Fe3++2I-=2Fe2++I2; I2+2S2O32-=2I-+S4O62-(无色)
滴定时选用的指示剂是___,硫酸亚铁样品溶液中铁元素总量是___g/L.实验过程中,若省略步骤“加热煮沸一定时间”,对滴定结果有何影响,请说明判断的理由___.

请回答下列问题:
(1)实验需要大约100mL的1:9硫酸(浓硫酸与溶剂水的体积比),配制该硫酸时需要的玻璃仪器是:玻璃棒、___,配制过程是___.
(2)限用以下试剂:蒸馏水、稀硫酸、KSCN溶液、K3[Fe(CN)6]溶液、新制氯水
某同学通过实验判断硫酸亚铁晶体已部分变质,他设计的实验是:将硫酸亚铁晶体溶于稀硫酸中,加少量水稀释,___(请将操作、现象、结论补充完整).
(3)上述过程制得某种聚铁[Fe2(OH)4SO4]4的化学方程式是___.
(4)测定硫酸亚铁样品溶液中铁元素总量的实验如下:准确量取5.00mL溶液放入带塞的锥形瓶中,加入足量H2O2,加热煮沸一定时间,加入过量KI,充分反应后,再用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
提示:2Fe3++2I-=2Fe2++I2; I2+2S2O32-=2I-+S4O62-(无色)
滴定时选用的指示剂是___,硫酸亚铁样品溶液中铁元素总量是___g/L.实验过程中,若省略步骤“加热煮沸一定时间”,对滴定结果有何影响,请说明判断的理由___.
▼优质解答
答案和解析
(1)100mL的1:9硫酸需要浓硫酸10mL、水90mL,用量筒量取90mL水置于烧杯中,再量取10mL浓硫酸沿玻璃棒缓缓加入到烧杯中,边加边搅拌,
故答案为:烧杯、量筒;用量筒量取90mL水置于烧杯中,再量取10mL浓硫酸沿玻璃棒缓缓加入到烧杯中,边加边搅拌;
(2)硫酸亚铁晶体已部分变质,被氧化生成硫酸铁,为硫酸亚铁与硫酸铁的混合物,检验部分变质的方案为:将硫酸亚铁晶体溶于稀硫酸中,加少量水稀释,取两份溶液,一份溶液中加入KSCN溶液,溶液变成红色证明已变质,另一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀证明部分变质,
故答案为:取两份溶液,一份溶液中加入KSCN溶液,溶液变成红色证明已变质,另一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀证明部分变质;
(3)由流程图可知,硫酸亚铁、NaClO3在酸性条件得到[Fe2(OH)4SO4]4,氯元素被还原生成NaCl,根据守恒可知,还生成H2SO4,反应方程式为:24FeSO4+4NaClO3+36H2O=3[Fe2(OH)4SO4]4+4NaCl+12H2SO4,
故答案为:24FeSO4+4NaClO3+36H2O=3[Fe2(OH)4SO4]4+4NaCl+12H2SO4;
(4)碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失且半分钟不变色说明反应到达终点,
由关系式Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.5000mol/L×0.02L=0.01mol,铁元素总含量为:
=112g/L;
残留的H2O2将KI氧化成I2,使Na2S2O3标准溶液用量偏大,导致测定的铁元素总量偏高,
故答案为:淀粉溶液;112;偏高,残留的H2O2将KI氧化成I2,使Na2S2O3标准溶液用量偏大,导致测定的铁元素总量偏高.
故答案为:烧杯、量筒;用量筒量取90mL水置于烧杯中,再量取10mL浓硫酸沿玻璃棒缓缓加入到烧杯中,边加边搅拌;
(2)硫酸亚铁晶体已部分变质,被氧化生成硫酸铁,为硫酸亚铁与硫酸铁的混合物,检验部分变质的方案为:将硫酸亚铁晶体溶于稀硫酸中,加少量水稀释,取两份溶液,一份溶液中加入KSCN溶液,溶液变成红色证明已变质,另一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀证明部分变质,
故答案为:取两份溶液,一份溶液中加入KSCN溶液,溶液变成红色证明已变质,另一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀证明部分变质;
(3)由流程图可知,硫酸亚铁、NaClO3在酸性条件得到[Fe2(OH)4SO4]4,氯元素被还原生成NaCl,根据守恒可知,还生成H2SO4,反应方程式为:24FeSO4+4NaClO3+36H2O=3[Fe2(OH)4SO4]4+4NaCl+12H2SO4,
故答案为:24FeSO4+4NaClO3+36H2O=3[Fe2(OH)4SO4]4+4NaCl+12H2SO4;
(4)碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失且半分钟不变色说明反应到达终点,
由关系式Fe3+~S2O32-,则n(Fe3+)=n(S2O32-)=0.5000mol/L×0.02L=0.01mol,铁元素总含量为:
| 56g/mol×0.01mol |
| 0.005L |
残留的H2O2将KI氧化成I2,使Na2S2O3标准溶液用量偏大,导致测定的铁元素总量偏高,
故答案为:淀粉溶液;112;偏高,残留的H2O2将KI氧化成I2,使Na2S2O3标准溶液用量偏大,导致测定的铁元素总量偏高.
看了 聚合硫酸铁([Fe2(OH)...的网友还看了以下:
经长期观测,某海滨浴场七月份每天海浪的高度为y(米)可近似地看成关于时间t(0≤t≤24,单位:小 2020-05-16 …
在某地区,高度每升高100米,气温下降0.5℃.若在该地区上海拔300米处的某观测点A测得气温是2 2020-05-17 …
已知某监测点空气中二氧化硫样品测试的吸光度为0.141,试剂空白的吸光度为0.002,采样流量为0 2020-06-03 …
在某项测量中,测量结果X服从正态分布N(1,σ2)(σ>0),若X在(0,2)内取值的概率为0.8 2020-06-10 …
2个测井方面的计算题1.在砂泥岩剖面上(GCUR=2.0),某井测井响应特征为:SP=-60mv, 2020-06-29 …
电子测量与仪器求答案1.某待测电流约为200mA,现有0.1级量程为0~400mA的电流表,分别计 2020-08-02 …
(共10分)为了精确测量某待测电阻Rx的阻值(约为30Ω).有以下一些器材可供选择.电流表:A1(量 2020-12-05 …
有0~0.6A和0~3A两个量程的电流表,某次测量中用0~0.6A的量程,从0~3A量程的刻度盘上发 2020-12-05 …
4.某观测员用基座安置GPS天线,测值分3个互为120°的位置量取天线高,读数分别为0.073、0. 2020-12-05 …
准确值和估计值是否应该带单位?比如某测量结果为12.34cm,则准确值和估计值是12.3cm和0.0 2020-12-31 …