早教吧作业答案频道 -->化学-->
钨是熔点最高的金属,是重要的战略物资.自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.由黑钨矿冶炼钨的工艺流程如图:已知:①滤渣I的主要
题目详情
钨是熔点最高的金属,是重要的战略物资.自然界中钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.由黑钨矿冶炼钨的工艺流程如图:
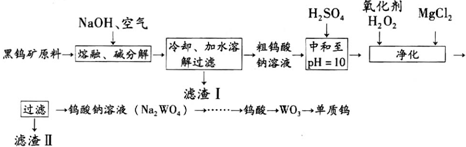
已知:①滤渣I的主要成份是Fe2O3、MnO2.
②上述流程中,除最后一步外,其余步骤钨的化合价未变.
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为___,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___,滤渣Ⅱ的主要成分是___.
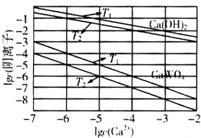
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=___mol•L-1.将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为___,T2时该反应的平衡常数为___mol•L-1.
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2.该阳极反应式为___.

已知:①滤渣I的主要成份是Fe2O3、MnO2.
②上述流程中,除最后一步外,其余步骤钨的化合价未变.
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为___,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式___.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___,滤渣Ⅱ的主要成分是___.
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=___mol•L-1.将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为___,T2时该反应的平衡常数为___mol•L-1.
(4)硬质合金刀具中含碳化钨(WC),利用电解法可以从碳化钨废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,HCl溶液为电解液,阳极析出钨酸并放出CO2.该阳极反应式为___.

▼优质解答
答案和解析
(1)钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+x+(-2)×4=0,解得x=+6,黑钨矿的主要成分是铁和锰的钨酸盐,根据流程图的提示知,黑钨矿在空气中熔融生成WO42-、MnO2,、Fe2O3等,其中转化中生成MnO2的化学反应方程式为2MnWO4+O2+4NaOH=2MnO2+2Na2WO4+2H2O,
故答案为:+6;2MnWO4+O2+4NaOH
2MnO2+2Na2WO4+2H2O;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,滤液I中存在SiO32-、HAsO32-、HAsO42-、HPO42-等离子,经过调解pH值后,加入氯化镁,Mg2+沉淀SiO32-、HAsO32-、HAsO42-、HPO42-等离子,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4,
故答案为:H2O2+HAsO32-═HAsO42-+H2O;MgSiO3、MgHAsO4、MgHPO4;
(3)T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2=CaWO4+2OH-,T2时,C(OH-)=10-2mol/L,c(WO42-)=10-7mol/L,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=
=
=1×103,
故答案为:1×10-10;WO42-+Ca(OH)2=CaWO4+2OH-;1×103;
(4)电解时,阴极是氢离子放电生成氢气,电极反应式是2H++2e-=H2↑,阳极是碳化钨失去电子,发生氧化反应:WC+6H2O-10e-=H2WO4+CO2↑+10H+,
故答案为:WC+6H2O-10e-=H2WO4+CO2↑+10H+.
故答案为:+6;2MnWO4+O2+4NaOH
| ||
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,滤液I中存在SiO32-、HAsO32-、HAsO42-、HPO42-等离子,经过调解pH值后,加入氯化镁,Mg2+沉淀SiO32-、HAsO32-、HAsO42-、HPO42-等离子,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4,
故答案为:H2O2+HAsO32-═HAsO42-+H2O;MgSiO3、MgHAsO4、MgHPO4;
(3)T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2=CaWO4+2OH-,T2时,C(OH-)=10-2mol/L,c(WO42-)=10-7mol/L,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=
| C2(OH-) |
| C(WO42-) |
| (10-2)2 |
| 10-7 |
故答案为:1×10-10;WO42-+Ca(OH)2=CaWO4+2OH-;1×103;
(4)电解时,阴极是氢离子放电生成氢气,电极反应式是2H++2e-=H2↑,阳极是碳化钨失去电子,发生氧化反应:WC+6H2O-10e-=H2WO4+CO2↑+10H+,
故答案为:WC+6H2O-10e-=H2WO4+CO2↑+10H+.
看了 钨是熔点最高的金属,是重要的...的网友还看了以下:
如图,点P,Q分别是边长1㎝的正方形ABCD的边BC和对角线AC上的两个动点,点P从B出发,朝BC 2020-04-27 …
如图,点P,Q分别是边长1㎝的正方形ABCD的边BC和对角线AC上的两个动点,点P从B出发,朝BC 2020-04-27 …
点P,Q分别是边长为1CM的正方形ABCD的边BC和对角线AC上的两个动点,点P从B出发,朝BC方 2020-06-03 …
U.S.A.后要不要加句点当U.S.A.位于句尾时,需不需要在“A.”后再加句点(“.”)? 2020-06-17 …
利用钨制作灯泡里的灯丝,而不用锡的主要原因是()A.钨有导电性,而锡没有B.钨很细,而锡很粗C.钨 2020-07-07 …
已知面积S,S内有很~多个点.点间间距0.5M.求面积S内最多有多少个点.例如1平米的地方内有9个 2020-07-10 …
化学与生活息息相关,下列说法不正确的是()A.在汽油中添加乙醇制得的乙醇汽油可以减少空气污染B.白 2020-07-28 …
(200y•大庆)下表列出了部分金属s熔点和沸点(在标准大气压下),根据表中s数据,下列说法中正确 2020-07-28 …
根据下列物质的熔点,回答下列问题:物质名称固态水银固态煤油固态酒精金铜钢钨熔点/℃-39-30-1 2020-07-28 …
用一元一次不等式解决问题:某工地要实施爆破,导火线的烧烧速度为0.8cm/s,点燃导火线的人要在爆破 2020-11-21 …