早教吧作业答案频道 -->化学-->
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微量的铜、硼、镓、硒等.请回答:(1)基态Cu2+的核外电子排布式为;已知高温下Cu20比CuO更稳
题目详情
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微量的铜、硼、镓、硒等.
请回答:
(1)基态Cu2+的核外电子排布式为___;已知高温下Cu20比CuO更稳定,试从铜原子核外电子结构角度解释其原因___.
(2)铜与类卤素(CN)2、(SCN)2反应生成Cu(CN)2、Cu(SCN)2.已经(CN)2分子中各原子最外层均为8电子稳定结构,则1mol(CN)2中含有π键的数目为___.
类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-S-C=S)的沸点,其原因为___.
(3)氮化硼(BN)晶体有多种结构.六方氮化硼是通常存在的稳定结构,与石墨相似,具有层状结构,可作髙温润滑剂;立方氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
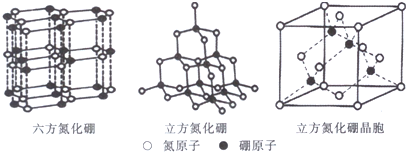
①关于两种晶体,下列说法正确的是___.
a.立方氮化硼含有σ键和π键,所以硬度大
b.六方氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
②立方氮化硼晶体中,硼原子的杂化轨道类型为___.
③立方氮化硼晶胞边长为acm,则其密度为___g/cm3(用含a的代数式表示).
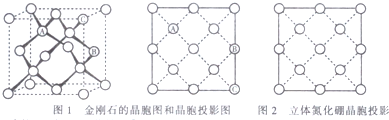
④如图1是金刚石的晶胞图和投影图,图2是立方氮化硼晶胞的投影图,请在图2中圆球上涂“●”和画“X”分别标明B与N的相对位置.
请回答:
(1)基态Cu2+的核外电子排布式为___;已知高温下Cu20比CuO更稳定,试从铜原子核外电子结构角度解释其原因___.
(2)铜与类卤素(CN)2、(SCN)2反应生成Cu(CN)2、Cu(SCN)2.已经(CN)2分子中各原子最外层均为8电子稳定结构,则1mol(CN)2中含有π键的数目为___.
类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-S-C=S)的沸点,其原因为___.
(3)氮化硼(BN)晶体有多种结构.六方氮化硼是通常存在的稳定结构,与石墨相似,具有层状结构,可作髙温润滑剂;立方氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.

①关于两种晶体,下列说法正确的是___.
a.立方氮化硼含有σ键和π键,所以硬度大
b.六方氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
②立方氮化硼晶体中,硼原子的杂化轨道类型为___.
③立方氮化硼晶胞边长为acm,则其密度为___g/cm3(用含a的代数式表示).
④如图1是金刚石的晶胞图和投影图,图2是立方氮化硼晶胞的投影图,请在图2中圆球上涂“●”和画“X”分别标明B与N的相对位置.

▼优质解答
答案和解析
(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,( SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(3)①a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误,
故选:bc;
②立方相氮化硼晶体中,硼原子形成4个σ键、没有孤电子对,杂化轨道数目为4,采取sp3杂化,故答案为:sp3;
③立方氮化硼中,晶胞边长为a cm,晶胞体积V=(acm)3,该晶胞中N原子个数=8×
+6×
=4、B原子个数为4,立方氮化硼的密度=
=
g/cm3=
g/cm3 ,
故答案为:
;
④如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用,所以其图为 ,
,
故答案为: .
.
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,( SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(3)①a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误,
故选:bc;
②立方相氮化硼晶体中,硼原子形成4个σ键、没有孤电子对,杂化轨道数目为4,采取sp3杂化,故答案为:sp3;
③立方氮化硼中,晶胞边长为a cm,晶胞体积V=(acm)3,该晶胞中N原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| V |
| 4×25 |
| NA×a3 |
| 100 |
| a3NA |
故答案为:
| 100 |
| a3NA |
④如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用,所以其图为
 ,
,故答案为:
 .
.
看了 太阳能的开发利用在新能源研究...的网友还看了以下:
1.69某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列论断:①一定 2020-05-22 …
根据如表数据,则与HClO3比,HClO具有的是()Cl-O键键长(pm)Cl-O键能(KJ/mo 2020-07-01 …
有10个布袋子,每个布袋子里都装有10坨金锭.其中9个布袋子里装的是10坨每坨10两的金锭,一个布 2020-07-05 …
(4分)氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436kJ/mo 2020-07-19 …
(1)配位键(即共用电子对由某原子单方面提供)O→O的电子式与O-O的电子式有什么不同?(2)Ca 2020-08-03 …
如图,质量为m的小球由长为L的细绳(质量不计)固定在O点,今将小球水平拉至A点静止释放,在O点正下方 2020-11-01 …
人类的ABO血型系统中,IA与IB为共显性基因,对i均为显性.一般情况下,下列婚配方式中不可能出现O 2020-11-04 …
有关拼音n和o不能拼读的解释吗?为什么l和o能拼读呢?谁能给出正确答案,要不会误导孩子的, 2020-11-28 …
王老师为幼儿园的小朋友买布狮子玩具,带了475元钱,她发现布狮子的价格比35元贵,买了12个布狮子后 2020-12-17 …
下列说法正确的是()A、钾(K)原子基态的原子结构示意图为B、H2O电子式为C、O的原子基态电子的轨 2020-12-28 …