早教吧作业答案频道 -->化学-->
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有Al2O3、CaO、MnO、Fe2O3、FeO、SiO2等杂质,以此为原料提取硫酸镁晶体和氢氧化铝.从硼镁泥中提取MgSO4•7H2O的流程如下:已知:NaClO与Mn2+
题目详情
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有Al2O3、CaO、MnO、Fe2O3、FeO、SiO2等杂质,以此为原料提取硫酸镁晶体和氢氧化铝.
从硼镁泥中提取MgSO4•7H2O的流程如下:
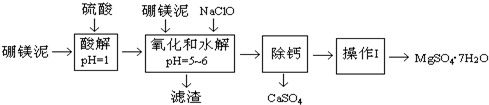
已知:NaClO与Mn2+反应产生MnO2沉淀.
请完成下列填空:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,除玻璃棒、胶头滴管、烧杯外,还需要的定量玻璃仪器有___(注明规格).
(2)加入的NaClO有三个作用,用离子方程式表示其中一个作用:___.
已知MgSO4、CaSO4的溶解度如下表:
(3)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,操作步骤依次为蒸发浓缩、___.操作Ⅰ中的步骤之一是洗涤沉淀,具体的操作方法是___.
(4)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为___.
(5)从硼镁泥提取硫酸镁晶体后的滤渣,主要还含有Al(OH)3、Fe(OH)3,MnO2、SiO2,先用稀盐酸除去MnO2和SiO2,请补全下面的流程图,完成从滤渣中获取Al(OH)3的方案(仿照上述流程图表示).
从硼镁泥中提取MgSO4•7H2O的流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,除玻璃棒、胶头滴管、烧杯外,还需要的定量玻璃仪器有___(注明规格).
(2)加入的NaClO有三个作用,用离子方程式表示其中一个作用:___.
已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为___.
(5)从硼镁泥提取硫酸镁晶体后的滤渣,主要还含有Al(OH)3、Fe(OH)3,MnO2、SiO2,先用稀盐酸除去MnO2和SiO2,请补全下面的流程图,完成从滤渣中获取Al(OH)3的方案(仿照上述流程图表示).

▼优质解答
答案和解析
硼镁泥中加入稀硫酸,MgO、Al2O3、CaO、MnO、Fe2O3、FeO都和稀硫酸反应生成可溶性硫酸盐和水,向溶液中加入NaClO并调节溶液的pH在5~6之间,锰离子被次氯酸根离子氧化生成二氧化锰沉淀,亚铁离子被次氯酸根离子氧化生成铁离子,根据氢氧化物沉淀需要的pH知,铁离子和铝离子都生成沉淀,然后除钙,使钙离子和硫酸根离子生成硫酸钙沉淀,将混合溶液过滤得到滤液,最后将滤液蒸发浓缩、冷却结晶得到硫酸镁晶体,
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,浓硫酸的物质的量浓度=
mol/L=18.4mol/L,浓硫酸的体积=
=4.3mL,所以需要选取10mL量筒,则除玻璃棒、胶头滴管、烧杯外,还需要的定量玻璃仪器有100mL的容量瓶、10mL量筒,
故答案为:10mL量筒、100mL容量瓶;
(2)次氯酸根离子具有强氧化性,能将锰离子、亚铁离子氧化为二氧化锰沉淀、铁离子,从而除去杂质离子,次氯酸根离子和氢离子反应生成次氯酸,从而调节溶液的pH,离子方程式为ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+⇌HClO,
故答案为:ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+⇌HClO;
(3)操作步骤依次为蒸发浓缩、趁热过滤,因为温度越高硫酸钙、硫酸镁的溶解度越小,所以要趁热过滤;
洗涤沉淀的方法为向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次,
故答案为:趁热过滤;向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次;
(4)如果测得提供的硼镁泥的质量为100.0g,硼镁泥中Mg的质量=100.0g×40%×
=24g
得到的MgSO4•7H2O 196.8g,Mg的质量=196.8g×
×100%=19.2g,则MgSO4•7H2O的产率=
×100%=80.0%,
故答案为:80.0%;
(5)滤渣中Al(OH)3、Fe(OH)3和稀盐酸反应生成生成可溶性氯化物,MnO2、SiO2和HCl不反应,然后向溶液中加入过量NaOH溶液,铝离子转化为偏铝酸根离子,铁离子转化为氢氧化铁沉淀,然后过滤,向滤液中通入二氧化碳达到氢氧化铝沉淀,然后过滤得到沉淀,用蒸馏水洗涤沉淀、干燥沉淀即可得到氢氧化铝固体,其流程图为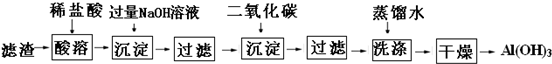 ,
,
故答案为: .
.
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸(密度1.84g/cm3)来配制,浓硫酸的物质的量浓度=
| 103×1.84×98% |
| 98 |
| 1.00mol/L×0.08L |
| 18.4mol/L |
故答案为:10mL量筒、100mL容量瓶;
(2)次氯酸根离子具有强氧化性,能将锰离子、亚铁离子氧化为二氧化锰沉淀、铁离子,从而除去杂质离子,次氯酸根离子和氢离子反应生成次氯酸,从而调节溶液的pH,离子方程式为ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+⇌HClO,
故答案为:ClO-+Mn2++H2O=2H++Cl-+MnO2↓、ClO-+2Fe2++2H+=Cl-+2Fe3++H2O、ClO-+H+⇌HClO;
(3)操作步骤依次为蒸发浓缩、趁热过滤,因为温度越高硫酸钙、硫酸镁的溶解度越小,所以要趁热过滤;
洗涤沉淀的方法为向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次,
故答案为:趁热过滤;向漏斗里加入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次;
(4)如果测得提供的硼镁泥的质量为100.0g,硼镁泥中Mg的质量=100.0g×40%×
| 24 |
| 40 |
得到的MgSO4•7H2O 196.8g,Mg的质量=196.8g×
| 24 |
| 246 |
| 19.2g |
| 24g |
故答案为:80.0%;
(5)滤渣中Al(OH)3、Fe(OH)3和稀盐酸反应生成生成可溶性氯化物,MnO2、SiO2和HCl不反应,然后向溶液中加入过量NaOH溶液,铝离子转化为偏铝酸根离子,铁离子转化为氢氧化铁沉淀,然后过滤,向滤液中通入二氧化碳达到氢氧化铝沉淀,然后过滤得到沉淀,用蒸馏水洗涤沉淀、干燥沉淀即可得到氢氧化铝固体,其流程图为
 ,
,故答案为:
 .
.
看了 硼镁泥是一种工业废料,主要成...的网友还看了以下:
已知长40厘米,宽30厘米的木料,加工后它的长和宽各减少了x厘米1、试写出加工后木料面积S与X关系 2020-05-14 …
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)CO(g)+H2( 2020-07-15 …
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既廉价又环保。(1)工业上可用组成为K2O·M 2020-07-20 …
起重机的吊钩下挂着质量为100Kg的木箱,如果木箱以加速度2m/s^2匀减速下降4m,求:⑴重力做的 2020-11-08 …
一道化学反应热计算题1、Ⅰ:水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的 2020-12-01 …
如图是一种染料敏化太阳能电池的示意图.电池的一个点极由有机光敏燃料(S)涂覆在TiO2纳米晶体表面制 2020-12-27 …
(2013•江苏一模)下列关于艾弗里的肺炎双球菌转化实验的叙述,错误的是()A.需要对S型细菌中的物 2021-01-08 …
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。(1)工业上可用组成为K2O·M2 2021-01-29 …
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既廉价又环保.(1)工业上可用组成为K2O•M2 2021-01-29 …
(2013•福建)利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保.(1)工业上可用 2021-01-29 …