早教吧作业答案频道 -->化学-->
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:(l)已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1在恒温、恒容的密闭容器中,合成氨反应的各
题目详情
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(l)已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
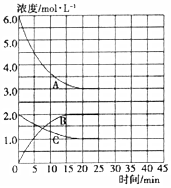
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示.
①计算在该温度下反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=___.
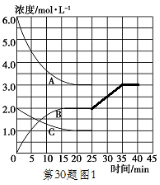
②在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡.在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线.
③已知:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)△H=+1530.0KJ/mol,则氢气的燃烧热为___.
(2)①N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:___.
②用NaClO与NH3 制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-═OH-+NH2Cl
请写出第二步离子方程式___:
③N2H4易溶于水,是与氨相类似的弱碱,己知其常温下电离常数K1=1.0×10-6,常温下,将0.2mol/L N2H4•H2O与0.lmol/L,盐酸等体积混合(忽略体积变化).则此时溶液的PH等于___ (忽略N2H4的二级电离).
(l)已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示.
①计算在该温度下反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=___.
②在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡.在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线.
③已知:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)△H=+1530.0KJ/mol,则氢气的燃烧热为___.
(2)①N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:___.
②用NaClO与NH3 制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-═OH-+NH2Cl
请写出第二步离子方程式___:
③N2H4易溶于水,是与氨相类似的弱碱,己知其常温下电离常数K1=1.0×10-6,常温下,将0.2mol/L N2H4•H2O与0.lmol/L,盐酸等体积混合(忽略体积变化).则此时溶液的PH等于___ (忽略N2H4的二级电离).

▼优质解答
答案和解析
(1)①由图可知,A为氢气,C为氮气,B为氨气,平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,该温度下反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K=
=6.75,
故答案为:6.75;
②降低温度,平衡向放热反应方向移动,也就量向平衡向氨气浓度增大的方向移动,平衡移动过程中N2浓度变化了0.5mol/L,则氨气浓度变化1mol/L,由此作出图象为:
( ,
,
故答案为: ;
;
③Ⅰ.N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)△H=+1530.0KJ/mol,
盖斯定律计算(Ⅰ×2-Ⅱ)×
得到H2(g)+
O2(g)=H2O(l),△H=-285.8KJ/mol,
故答案为:-285.8KJ/mol;
(2)①N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O,次氯酸钠过量会氧化N2H4生成氮气,
故答案为:过量的NaClO可能将N2H4氧化为N2;
②该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O,已知第一步:NH3+ClO-═OH-+NH2Cl,第二步离子方程式NH3+NH2Cl+OH-=N2H4+Cl-+H2O,
故答案为:NH3+NH2Cl+OH-=N2H4+Cl-+H2O;
③N2H4易溶于水,是与氨相类似的弱碱,电离方程式为:N2H4+H2O⇌N2H5++OH-,己知其常温下电离常数K1=1.0×10-6,常温下,将0.2mol/L N2H4•H2O与0.lmol/L,盐酸等体积混合(忽略体积变化).得到等量的N2H4•H2O、N2H5C1,浓度为0.05mol/L,
平衡常数K=
=1.0×10-6,c(OH-)=10-6mol/L,c(H+)=
=10-8mol/L,
则此时溶液的PH等于8,
故答案为:8.
| 33×1 |
| 22 |
故答案为:6.75;
②降低温度,平衡向放热反应方向移动,也就量向平衡向氨气浓度增大的方向移动,平衡移动过程中N2浓度变化了0.5mol/L,则氨气浓度变化1mol/L,由此作出图象为:
(
 ,
,故答案为:
 ;
;③Ⅰ.N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)△H=+1530.0KJ/mol,
盖斯定律计算(Ⅰ×2-Ⅱ)×
| 1 |
| 6 |
| 1 |
| 2 |
故答案为:-285.8KJ/mol;
(2)①N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O,次氯酸钠过量会氧化N2H4生成氮气,
故答案为:过量的NaClO可能将N2H4氧化为N2;
②该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O,已知第一步:NH3+ClO-═OH-+NH2Cl,第二步离子方程式NH3+NH2Cl+OH-=N2H4+Cl-+H2O,
故答案为:NH3+NH2Cl+OH-=N2H4+Cl-+H2O;
③N2H4易溶于水,是与氨相类似的弱碱,电离方程式为:N2H4+H2O⇌N2H5++OH-,己知其常温下电离常数K1=1.0×10-6,常温下,将0.2mol/L N2H4•H2O与0.lmol/L,盐酸等体积混合(忽略体积变化).得到等量的N2H4•H2O、N2H5C1,浓度为0.05mol/L,
平衡常数K=
| c(OH-)c(N2H5+) |
| c(N2H4) |
| 10-14 |
| 10-6 |
则此时溶液的PH等于8,
故答案为:8.
看了 氨和肼(N2H4)是氮的两种...的网友还看了以下:
线性代数问题:A=|2 3|,B=|1 9| |-1 1| |-3 k| 若AB=BA,求k已经解 2020-05-13 …
不等式的问题对怎样的正整数k,有(3x^2+2x+2)/(x^2+x+1)>k解是这样解的x^2+ 2020-05-13 …
非齐次线性方程组问k值(k+1)x1+x2+x3=0x1+(k+1)x2+x3=3x1+x2+(k 2020-05-13 …
直线的点斜式方程问题1、求直线y=-1/2x+1的一个方向向量2、若直线y-3=k(x-5)过点( 2020-05-22 …
二次函数对称轴与区间问题求解y=kx^2+(3+k)x+3在区间(-1,4)有最大值4我知道要对k 2020-06-02 …
数学分式方程的一些小问题(1)已知分式方程(x+1/x-1)=a/3-x有增根,求a的值.(2)关 2020-06-06 …
十字相乘符号问题例如k^2-6k-27十字相乘法131-9(k+3)(k-9)为什么不是1-319 2020-07-17 …
1+2+3+4+5+.+n=0.5n^2+n1^2+2^2+3^2.+n^2=n(n+1)(2n+ 2020-08-03 …
求数列1^k+2^k+3^k+...+n^k的和如题,已求出当k=1时值为1/2n^2+1/2n,当 2020-12-31 …
已知3(k+1)=81,试求k的值.小红:因为81=3(4),所以3(k+1)=3(4),所以k+1 2021-01-05 …