早教吧作业答案频道 -->化学-->
氢氟酸可用于半导体工业,也常用来蚀刻玻璃,其刻蚀反应原理如下:6HF+Na2SiO3→2NaF+SiF4↑+3H2O完成下列填空:(1)根据HF的(选填编号)大于H2O,可推断氟元素的非金属性强于氧元素.a
题目详情
氢氟酸可用于半导体工业,也常用来蚀刻玻璃,其刻蚀反应原理如下:
6HF+Na2SiO3→2NaF+SiF4↑+3H2O
完成下列填空:
(1)根据HF的___(选填编号)大于H2O,可推断氟元素的非金属性强于氧元素.
a.酸性 b.熔沸点 c.稳定性 d.键的极性
(2)SiF4与甲烷结构相似,SiF4是含___键的___分子(均选填“极性”或“非极性”).
刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物,该化合物的电子式为___.
(3)Si原子核外电子有___种不同能量的电子,其中最高能量的电子处于___轨道.
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,两个反应原理相似,但前者的反应速率明显大于后者.原因是___.
(5)同浓度的H2SO3和HF两溶液的pH为:H2SO3___HF(选填“>”或“<”).浓度均为0.01mol/L 的H2SO3和HF的1L混合溶液中,通入0.02mol NH3充分反应后,SO32-、HSO3-、F-、NH4+浓度从大到小的顺序为:___.
已知:H2SO3 Ki1=1.54×10-2Ki2=1.02×10-7
HF Ki=6.8×10-4
NH3•H2O Ki=1.8×10-5.
6HF+Na2SiO3→2NaF+SiF4↑+3H2O
完成下列填空:
(1)根据HF的___(选填编号)大于H2O,可推断氟元素的非金属性强于氧元素.
a.酸性 b.熔沸点 c.稳定性 d.键的极性
(2)SiF4与甲烷结构相似,SiF4是含___键的___分子(均选填“极性”或“非极性”).
刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物,该化合物的电子式为___.
(3)Si原子核外电子有___种不同能量的电子,其中最高能量的电子处于___轨道.
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,两个反应原理相似,但前者的反应速率明显大于后者.原因是___.
(5)同浓度的H2SO3和HF两溶液的pH为:H2SO3___HF(选填“>”或“<”).浓度均为0.01mol/L 的H2SO3和HF的1L混合溶液中,通入0.02mol NH3充分反应后,SO32-、HSO3-、F-、NH4+浓度从大到小的顺序为:___.
已知:H2SO3 Ki1=1.54×10-2Ki2=1.02×10-7
HF Ki=6.8×10-4
NH3•H2O Ki=1.8×10-5.
▼优质解答
答案和解析
(1)通过氢化物的稳定性可以判断非金属性强弱,氢化物的稳定性与键的极性有关,所以符合推断氟元素的非金属性强于氧元素条件的为cd,
故答案为:cd;
(2)SiF4中硅原子和氟原子之间以极性共价键结合,SiF4与甲烷结构相似,甲烷为正四面体结构,所以SiF4从整个分子来看,电荷的分布是均匀的,对称的,为非极性分子,刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物为氢氧化钠,其电子式为: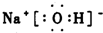 ,
,
故答案为:极性;非极性;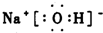 ;
;
(3)硅原子为14号元素,电子排布式1s22s22p63s23p2,共有5个轨道上排布电子,所以有5种不同能量的电子,原子核外电子是分层排布的,距离原子核越近能量越低,所以3p能量最高,
故答案为:5;3p;
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,Na2SiO3与氢氟酸反应生成的NaF易溶于水,而CaSiO3与氢氟酸反应生成的CaF2难溶于水,会覆盖在固体表面,降低反应速率,所以前者的反应速率明显大于后者,
故答案为:NaF易溶于水,而CaF2难溶于水,会覆盖在固体表面,降低反应速率.
(5)H2SO3 Ki1=1.54×10-2大于HF Ki=6.8×10-4,所以同浓度,亚硫酸酸性强于氢氟酸,即PH小于氢氟酸,浓度均为0.01mol/L 的H2SO3和HF的1L混合溶液中,通入0.02mol NH3充分反应后,生成等浓度的亚硫酸氢铵、氟化铵,HF Ki=6.8×10-4 大于NH3•H2O Ki=1.8×10-5大于H2SO3 Ki2=1.02×10-7
,所以亚硫酸氢根离子水解能力强于氟离子,溶液中离子浓度为:c(NH4+)>c(F-)>c(HSO3-)>c(SO32-),
故答案为:<;c(NH4+)>c(F-)>c(HSO3-)>c(SO32-).
故答案为:cd;
(2)SiF4中硅原子和氟原子之间以极性共价键结合,SiF4与甲烷结构相似,甲烷为正四面体结构,所以SiF4从整个分子来看,电荷的分布是均匀的,对称的,为非极性分子,刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物为氢氧化钠,其电子式为:
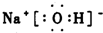 ,
,故答案为:极性;非极性;
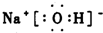 ;
;(3)硅原子为14号元素,电子排布式1s22s22p63s23p2,共有5个轨道上排布电子,所以有5种不同能量的电子,原子核外电子是分层排布的,距离原子核越近能量越低,所以3p能量最高,
故答案为:5;3p;
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,Na2SiO3与氢氟酸反应生成的NaF易溶于水,而CaSiO3与氢氟酸反应生成的CaF2难溶于水,会覆盖在固体表面,降低反应速率,所以前者的反应速率明显大于后者,
故答案为:NaF易溶于水,而CaF2难溶于水,会覆盖在固体表面,降低反应速率.
(5)H2SO3 Ki1=1.54×10-2大于HF Ki=6.8×10-4,所以同浓度,亚硫酸酸性强于氢氟酸,即PH小于氢氟酸,浓度均为0.01mol/L 的H2SO3和HF的1L混合溶液中,通入0.02mol NH3充分反应后,生成等浓度的亚硫酸氢铵、氟化铵,HF Ki=6.8×10-4 大于NH3•H2O Ki=1.8×10-5大于H2SO3 Ki2=1.02×10-7
,所以亚硫酸氢根离子水解能力强于氟离子,溶液中离子浓度为:c(NH4+)>c(F-)>c(HSO3-)>c(SO32-),
故答案为:<;c(NH4+)>c(F-)>c(HSO3-)>c(SO32-).
看了 氢氟酸可用于半导体工业,也常...的网友还看了以下:
一道简单不等式(1)已知不等式ax2-x-2>0在a属于[1,2]上恒成立,求x的取值范围(2)已 2020-04-27 …
用反余弦的形式把下列各式中的x(x属于[0,TT])表示出来:1.cosx=2/3;2.cosx= 2020-05-13 …
用反正弦表求下列角xsinx=a,x属于(π,2π),其中a属于(-1,0) 2020-05-20 …
急求高次不等式1)设不等式ax^2-(a+1)x-3>0对一切a属于(1,2]都成立,求x的范围. 2020-06-10 …
高数证明题1设函数f(x)在[1.2]上连续,在{1,2}内可导,且f(2)=0,F(x)=(x- 2020-07-22 …
满足{1,2}属于A属于{1,2,3,4,5}条件的集合A的个数请把所有可能出现的结果一一列举出来 2020-07-30 …
1.若对于任意a属于[-1,1],函数f(x)=x^2+(a-4)x+4-2a的值恒大于零,则x的 2020-08-01 …
对任意a属于[-1,1]函数f(x)=x^2+(a-4)*x+2-a的值恒大于零,求x的取值范围这 2020-08-02 …
第一个,对于任意a属于-1到1,包括-1和1,函数F(X)=X^2+(a-4)x+4-2a的值总大于 2020-12-08 …
实数a属于[-1,1],b属于[0,2],设函数f(x)=-1/3x^3+1/2x^2+bxdel的 2020-12-23 …