实验室制备12—二溴乙烷的反应原理如下:可能存在的的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用16.0g的溴和足量的乙醇制备12—二溴乙烷,实验结束后得到9.4g
实验室制备1 2—二溴乙烷的反应原理如下:
![]()
可能存在的的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用16.0g的溴和足量的乙醇制备1 2—二溴乙烷,实验结束后得到9.4g产品。实验装置如下图所示:
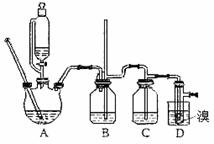
有关数据列表如下:
| 乙醇 | 1 2—二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度 / g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点 / 0C | 78.5 | 132 | 34.6 |
| 熔点 / 0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是 (填正确选项前的字母);
a、引发反应 b、加快反应速度
c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是 。
(4)将1 2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是 ;
(6)反应过程中应用冷水冷却装置D,其主要目的是 ,但又不能过度冷却(如用冰水),其原因是 ;
(7)本实验中,1 2—二溴乙烷的产率为 。
【答案】(共11分)
(1)d(1分);
(2)c(1分);
(3)溴的颜色完全褪去(1分);
(4)下(1分);
(5)防止堵塞(2分);
(6)减小溴的挥发(1分) 防止蒸气凝固堵塞导管(2分)
(7)50%(2分)
【解析】
试题分析:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,选项d符合题意;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,选项c符合题意;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,故当溴水颜色完全褪去可证明反应完全;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,产物应在下层;
(5)装置B为安全瓶,如果发生堵塞,长导管内溶液液面上升;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,
(7)16.0g的溴的物质的量为0.1mol,完全反应理论生成1,2-二溴乙烷的质量为18.8克,现实际得到9.4克,很明显产率为50%。
考点:有机化工实验流程
如何配制500ml0.01mol/L盐酸乙醇?市售黄色冒烟的盐酸和无水乙醇如何配制含量在31-33 2020-04-27 …
有关水提醇沉的问题.采用水提醇沉法精制药液,现在药材水煎浓缩液1000ml,欲使药液含醇量达70% 2020-04-27 …
在电视中提到JACKDANIELS杰克·丹尼尔斯世界十大名酒之一是经过碳醇,我在商店也买到经过碳醇 2020-05-23 …
甲醇精馏过程中乙醇高如何处理?由于预塔进料粗甲醇含量在2%左右,常压塔采出乙醇高的有点离谱,最高达 2020-06-25 …
陈皮的乙醇浸出制剂中,在已经过浸出、虑过后,为什么最后还要进行含醇量测定?回答能否具体下?如要控制 2020-07-04 …
如图表示人体细胞中胆固醇的两种来源.细胞能利用乙酰COA合成胆固醇;血浆中的LDL(一种胆固醇量占 2020-07-10 …
陈皮的乙醇浸出制剂中,在已经过浸出、虑过后,为什么最后还要进行含醇量测定?回答能否具体下?如要控制 2020-07-12 …
酊剂中乙醇量甲醇量算有关物质吗?做方法学确认时需要进行对乙醇量和甲醇量做确认吗? 2020-07-28 …
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按表所示的量和反应条件在三颈瓶中加入一定 2020-11-28 …
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓硫酸混合,然后经分液漏斗边滴加醋 2020-11-29 …