早教吧作业答案频道 -->化学-->
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的
题目详情
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子.回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为___,Y2X2分子中σ键和π键个数比为___.
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是___.
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是___.
(4)元素W能形成多种配合物,如:W(CO)5等.
①基态W3+的M层电子排布式为___.
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于___(填晶体类型),该晶体中W的化合价为___.
(5)下列有关的说法正确的是___.
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸
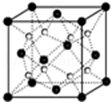
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___.已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=___cm.(用含ρ、NA的计算式表示)

(1)Y2X2分子中Y原子轨道的杂化类型为___,Y2X2分子中σ键和π键个数比为___.
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是___.
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是___.
(4)元素W能形成多种配合物,如:W(CO)5等.
①基态W3+的M层电子排布式为___.
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于___(填晶体类型),该晶体中W的化合价为___.
(5)下列有关的说法正确的是___.
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___.已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=___cm.(用含ρ、NA的计算式表示)
▼优质解答
答案和解析
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,则Y是C元素;Q原子基态时2p原子轨道上有2个未成对的电子,原子序数大于碳,核外电子排布式为1s22s22p4,则Q为O元素;Z的原子序数介于碳、氧之间,则Z为N元素;W元素的原子结构中3d能级有4个未成对电子,外围电子排布为3d64s2,则W为Fe.
(1)Y2X2分子是C2H2,结构式为HC≡CH,分子中C原子轨道的杂化类型为sp杂化,单键为σ键,三键含有1个σ键、2个π键,分子中σ键和π键个数比为3:2,
故答案为:sp;3:2;
(2)化合物ZX3是NH3,在氨分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的吸引力,使其的沸点比只有分子间作用力的化合物CH4的高,
故答案为:NH3分子间存在氢键;
(3)等电子体是原子数相同,原子最外层电子数也相同的微粒.元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,它们是CO2与N2O,则元素Z的这种氧化物的分子式是N2O,
故答案为:N2O;
(4)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,基态Fe3+的M层电子排布式为3s23p63d5,
故答案为:3s23p63d5;
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,由于其熔沸点较低,易溶于非极性溶剂,所以据此可判断W(CO)x晶体属于分子晶体,在任何化合物水所有元素正负化合价的代数和为0,因此该晶体中W的化合价为0,
故答案为:分子晶体;0;
(5)A.分子晶体中,共价键键能越大,含有该共价键的物质的分子稳定性越强,而分子晶体的熔沸点与化学键的强弱无关,只与分子之间的作用力作用,因此不能判断物质的熔沸点的高低,故A错误;
B.元素的非金属性越强,其电负性就越大,元素的非金属性HC.KCl、CaO均属于离子晶体,离子电荷越大、离子半径越小,晶格能越大,因为晶格能CaO比KCl高,断裂消耗的能量就越大,所以KCl比CaO熔点低,故C正确;
D.H2CO3为弱酸,故D错误.
故选:BC;
(6)晶胞中白色球数目为8,黑色球数目为8×
+6×
=4,则白色球为钠离子、黑色球为氧离子,氧离子周围有8个钠离子,形成立方体结构;
根据均摊法计算晶胞中Na+个数、O2-个数,
在一个晶胞中含Na+个数是8;含有O2-个数是4,所以一个晶胞的质量为4×
g,该晶胞密度为ρ g/cm3,晶胞的边长是acm,则
=ρ g/cm3,整理可得a=
cm,
故答案为:立方体;
.
(1)Y2X2分子是C2H2,结构式为HC≡CH,分子中C原子轨道的杂化类型为sp杂化,单键为σ键,三键含有1个σ键、2个π键,分子中σ键和π键个数比为3:2,
故答案为:sp;3:2;
(2)化合物ZX3是NH3,在氨分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的吸引力,使其的沸点比只有分子间作用力的化合物CH4的高,
故答案为:NH3分子间存在氢键;
(3)等电子体是原子数相同,原子最外层电子数也相同的微粒.元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,它们是CO2与N2O,则元素Z的这种氧化物的分子式是N2O,
故答案为:N2O;
(4)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,基态Fe3+的M层电子排布式为3s23p63d5,
故答案为:3s23p63d5;
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,由于其熔沸点较低,易溶于非极性溶剂,所以据此可判断W(CO)x晶体属于分子晶体,在任何化合物水所有元素正负化合价的代数和为0,因此该晶体中W的化合价为0,
故答案为:分子晶体;0;
(5)A.分子晶体中,共价键键能越大,含有该共价键的物质的分子稳定性越强,而分子晶体的熔沸点与化学键的强弱无关,只与分子之间的作用力作用,因此不能判断物质的熔沸点的高低,故A错误;
B.元素的非金属性越强,其电负性就越大,元素的非金属性H
D.H2CO3为弱酸,故D错误.
故选:BC;
(6)晶胞中白色球数目为8,黑色球数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
根据均摊法计算晶胞中Na+个数、O2-个数,
在一个晶胞中含Na+个数是8;含有O2-个数是4,所以一个晶胞的质量为4×
| 62 |
| NA |
4×
| ||
| (acm)3 |
| 3 |
| ||
故答案为:立方体;
| 3 |
| ||
看了 原子序数依次递增且都小于36...的网友还看了以下:
下列叙述正确的是()A.NH3是极性分子,分子中N原子是在3个H原子所组成的三角形的中心B.CCl 2020-04-11 …
下列叙述正确的是()A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心B.CH2 2020-04-11 …
分子与原子的本质区别是()A.分子大,而原子小B.分子是构成物质的粒子,而原子则不是C.分子能保持 2020-06-05 …
0.05mol硫酸含有 molH原子,molS原子,molO原子,含有 个H原子,个S原子,个O原 2020-06-27 …
下列关于分子、原子、离子构成物质的说法中,不正确的是()A.氢原子结合成氢气B.汞原子聚集成金属汞 2020-07-12 …
下列说法正确的是()A.一切原子的原子核都是由质子和中子构成B.原子核内质子数一定等于中子数C.在 2020-07-15 …
已知一种碳-12原子的原子质量为x,现有甲,乙两种原子,其中甲原子与求啊,哭.已知一种碳-12原子 2020-07-22 …
下列关于原子的叙述正确的是()A.原子是最小的粒子B.原子中不存在电荷,因而原子不显电性C.原子不能 2020-12-21 …
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一 2021-01-05 …
如图是钠原子的原子结构示意图,钠原子相对原子质量为23,钠原子的核外电子数为,该原子的最外层电子数为 2021-01-20 …