早教吧作业答案频道 -->化学-->
Ⅰ.碱性锌锰干电池是最常见的化学电源之一,已知其电池总反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为;发生在正极的电极反应为.Ⅱ.回收的废旧锌锰干电池经过处
题目详情
Ⅰ.碱性锌锰干电池是最常见的化学电源之一,已知其电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为___;发生在正极的电极反应为___.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:
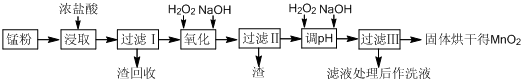
根据如图所示步骤并参考表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是___.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是___.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:___,其目的是___.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为___.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有___.
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为___;发生在正极的电极反应为___.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:

| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是___.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是___.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:___,其目的是___.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为___.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有___.
▼优质解答
答案和解析
Ⅰ负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OHˉ-2eˉ=Zn(OH)2,正极是二氧化锰得到电子生成MnO(OH),电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:Zn+2OHˉ-2eˉ=Zn(OH)2;MnO2+H2O+e-=MnO(OH)+OH-;
Ⅱ锰粉(含MnO2、MnOOH、Fe和炭黑等),锰粉在浓盐酸中浸泡(为除去MnO2可加热),发生MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O、Mn(OH)2+2HCl=MnCl2+2H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤液中含有Mn2+、Fe2+、NH4+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH在3.7~8.3之间可除去Fe3+,过滤后所得滤液主要为Mn2+,滤液中H2O2溶液,再加NaOH溶液调节pH值,使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,
(1)在加热条件下用浓盐酸浸取锰粉,加热的作用是加快反应速率,
故答案为:加快反应速率;
(2)过氧化氢具有强氧化性,可将具有还原性的Fe2+氧化为Fe3+,易于转化为Fe(OH)3而除去,
故答案为:将Fe2+转化为Fe3+;
(3)由表中数据可知,调节溶液PH约为5.1,在3.7~8.3之间,可使使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,
故答案为:3.7<pH<8.3;使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀;
(4)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,
故答案为:Mn2++H2O2+2OH-=MnO2↓+2H2O;
(5)过滤操作时.需要用到的玻璃仪器有 漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒.
故答案为:Zn+2OHˉ-2eˉ=Zn(OH)2;MnO2+H2O+e-=MnO(OH)+OH-;
Ⅱ锰粉(含MnO2、MnOOH、Fe和炭黑等),锰粉在浓盐酸中浸泡(为除去MnO2可加热),发生MnO2+4H++2Cl-
| ||
(1)在加热条件下用浓盐酸浸取锰粉,加热的作用是加快反应速率,
故答案为:加快反应速率;
(2)过氧化氢具有强氧化性,可将具有还原性的Fe2+氧化为Fe3+,易于转化为Fe(OH)3而除去,
故答案为:将Fe2+转化为Fe3+;
(3)由表中数据可知,调节溶液PH约为5.1,在3.7~8.3之间,可使使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,
故答案为:3.7<pH<8.3;使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀;
(4)过滤Ⅱ所得滤液中含有Mn2+,加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,
故答案为:Mn2++H2O2+2OH-=MnO2↓+2H2O;
(5)过滤操作时.需要用到的玻璃仪器有 漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒.
看了 Ⅰ.碱性锌锰干电池是最常见的...的网友还看了以下:
2mol氢气和1mol氧气化合生成2mol液态水,放出571.6kJ热量.能正确表示这一反应的热化 2020-04-07 …
已知浓硝酸是一种易挥发的强酸,见光易分解.其分解的反应方程式为:4HNO3△.2H2O+4NO2↑ 2020-05-13 …
在120℃时分别进行如下四个反应:在120℃时分别进行如下四个反应:A.2H2S+O2=2H2O+ 2020-05-14 …
铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极 2020-06-28 …
在120℃时分别进行如下四个反应:A.2H2S(气体)+O2=2H2O+2S↓B.2H2S(气体) 2020-07-20 …
根据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,回答下列问题:(1)用双线 2020-07-20 …
已知I-、Fe2+、SO2、Cl-均有还原性,它们还原性的强弱顺序是:SO2>I->Fe2+>Cl 2020-07-25 …
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:A.Na2O2+ 2020-11-23 …
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:A.Na2O2+ 2020-12-06 …
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:A.Na2O2+ 2020-12-22 …