早教吧作业答案频道 -->化学-->
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.6
题目详情
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
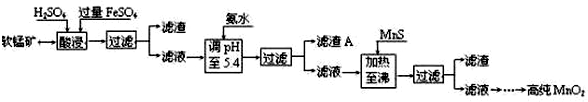
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为___.
(2)滤渣A的主要成分是___.
(3)加入MnS的目的是除去___杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___.
(5)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种).

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣A的主要成分是___.
(3)加入MnS的目的是除去___杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为___.
(5)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种).
▼优质解答
答案和解析
(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应的化学方程式为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣A的主要成分为:Fe(OH)3和Al(OH)3,
故答案为:Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:Cu2+、Zn2+;
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为:MnO2+H2O+e-=MnOOH+OH-,
故答案为:MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-);
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2,
故答案为:锌、二氧化锰.
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣A的主要成分为:Fe(OH)3和Al(OH)3,
故答案为:Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:Cu2+、Zn2+;
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为:MnO2+H2O+e-=MnOOH+OH-,
故答案为:MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-);
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2,
故答案为:锌、二氧化锰.
看了 二氧化锰是制造锌锰干电池的基...的网友还看了以下:
用竖式计算.(带★要验算)288÷42=★192÷27=★793÷26=595÷17=493÷57 2020-04-07 …
口算:31+47=9×5=710-420=46-18=380+530=6×6=810-490=34 2020-04-07 …
用冒泡排序法对下列数据12,37,42,19,27,35,56,44,10进行从小到大排序。在将最大 2020-05-24 …
用公式(x+a)(x+b)=x^2+(a+b)x+ab证明下面的规律1.16×14=224=1×( 2020-06-08 …
问下锰行业达人:碳酸锰的检测方法.(不是矿石,是成品碳酸锰).我需要检测方法和检测所用的试剂,包括 2020-06-14 …
我国湘黔渝三地交界地区是中国电解锰企业最集中的地区被称为中国的“锰三角”。金属锰的熔点很高常用铝热 2020-06-14 …
取含MnO2的软锰矿石27.86g,与足量的浓盐酸反应(杂志不反映)制得5.6LCL2求1软锰矿石 2020-07-01 …
简便计算(104-38)/33(320*5)/160(150+50)/45460-(32*7)42 2020-07-09 …
如果第一个数是3=2+1第二个数是6=3+3第三个数是15=6+9第四个数是42=15+27观察猜 2020-07-16 …
把下面每组两道的算式合并成一道综合算式.6×7=42,42-15=27,综合式:.15+9=24, 2020-07-22 …