早教吧作业答案频道 -->化学-->
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锌粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料
题目详情
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锌粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
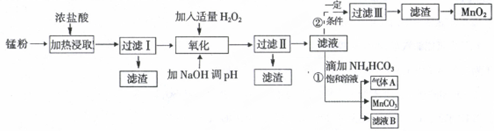
根据以上信息回答问题:
(1)过滤I得到的滤渣主要成分是___.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是___.
(3)过滤II后滤液中阳离子主要是___.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是___.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式___.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:___.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是___(保留2位有效数字).

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤I得到的滤渣主要成分是___.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是___.
(3)过滤II后滤液中阳离子主要是___.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是___.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式___.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:___.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是___(保留2位有效数字).
▼优质解答
答案和解析
锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]在浓盐酸中加热浸取,发生MnO2+4H++2Cl- △ . Mn2++Cl2↑+2H2O、2MnO(OH)+6HCl=2MnCl2+Cl2↑+4H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤渣...
看了 面对日益严重的环境问题,“变...的网友还看了以下:
下列物质的化学式书写正确的是()A.氧化镁:Mg2OB.氢氧化锌:Zn(HO)2C.氢氧化钠:Na 2020-05-02 …
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探 2020-05-13 …
某小组为研究电化学原理,设计如图所示装置:(1)a和b不相连,c是铜片,d是锌片,m是稀硫酸,锌片 2020-05-14 …
银锌电池的充放电过程:2Ag+Zn(OH)2=Ag2O+Zn+H2O在此电池放电时,负极上发生反应 2020-05-14 …
本品为复方制剂,每瓶含葡萄糖酸钙【Ca(C6H11O7)2】600 mg、葡萄糖酸锌【Zn(C6H 2020-05-14 …
【高一化学】原电池的反应问题》》》目前常用的银锌电池的总反映为Ag2O+Zn+H2O=放电=》/《 2020-05-14 …
在标准状况下,1mol锌与足量的稀硫酸完全反应,可生成氢气多少升?生成硫酸锌物质的量为多少摩尔?若 2020-05-16 …
(4)某幼儿每日服用一定量该葡萄糖酸钙锌口服溶液,若他每日摄入的口服液含15 mg 葡萄糖 2020-05-16 …
将5g某样品为cu和zn的合金放入烧杯中,分3次加入稀盐酸反应,所做实验结果记录如下:实验加入稀盐 2020-05-22 …
阅读××牌儿童营养蜜说明书并回答问题.营养成分表(每100g本品含):VA1000-1200ug烟 2020-06-23 …