下表列出了两种燃煤烟气脱硫方法的原理.方法Ⅰ将SO2与I2反应制H2SO4和HI,同时分解HI制H2和I2,I2循环
下表列出了两种燃煤烟气脱硫方法的原理.
| 方法Ⅰ | 将SO 2 与I 2 反应制H 2 SO 4 和HI,同时分解HI制H 2 和I 2 ,I 2 循环使用 |
| 方法Ⅱ | 用Na 2 SO 4 溶液吸收SO 2 ,再用离子膜电解法电解吸收液得到单质硫 |
(1)方法Ⅰ中,用SO 2 与碘反应生成H 2 SO 4 和HI,SO 2 与I 2 反应的物质的量之比为 ;制得的H 2 可用储氢合金转化为MH,现分别用NiO(OH)、MH作正、负极材料,KOH溶液作电解质,可制得高容量的镍氢电池.电池总反应为:
NiO(OH)+MH ![]() Ni(OH) 2 +M 则电池放电时,负极的电极反应式为 ,充电完成时,Ni(OH) 2 全部转化为NiO(OH).若继续充电将在一个电极产生O 2 ,O 2 扩散到另一电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为 .
Ni(OH) 2 +M 则电池放电时,负极的电极反应式为 ,充电完成时,Ni(OH) 2 全部转化为NiO(OH).若继续充电将在一个电极产生O 2 ,O 2 扩散到另一电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为 .
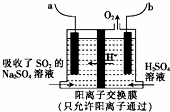
(2)利用如图装置可实现方法Ⅱ的转化.
①b端应连接电源的 (填“正极”或“负极”).
②用Na 2 SO 4 溶液代替水吸收烟气中的SO 2 使之转化为H 2 SO 3 ,其目的是 .
③电解过程中,阴极的电极反应式为 .
【考点】 二氧化硫的污染及治理;化学电源新型电池.
【专题】 电化学专题.
【分析】 (1)依据二氧化硫和碘单质在水溶液中发生氧化还原反应,结合定量关系分析判断;电池放电为原电池反应,负极为失电子发生氧化反应,充电时是原电池,NiO(OH)+MH ![]() Ni(OH) 2 +M,放电为原电池,正极发生还原反应,依据电池反应书写电极反应;根据氧气进入另一个电极后所引发的反应来回答;
Ni(OH) 2 +M,放电为原电池,正极发生还原反应,依据电池反应书写电极反应;根据氧气进入另一个电极后所引发的反应来回答;
(2)①用Na 2 SO 4 溶液吸收SO 2 ,再用离子膜电解法电解吸收液得到单质硫,依据氢离子移动方向可知,a为阴极,b为阳极;
②用Na 2 SO 4 溶液代替水吸收烟气中的SO 2 使之转化为H 2 SO 3 ,提高溶液导电性;
③电解池中阴极是二氧化硫得到电子生成硫单质.
【解答】 (1)用SO 2 与碘反应生成H 2 SO 4 和HI,反应的化学方程式为:SO 2 +I 2 +2H 2 O=H 2 SO 4 +2HI,SO 2 与I 2 反应的物质的量之比为1:1;
放电过程是原电池反应,正极发生还原反应,电极反应为:NiO(OH)+H 2 O+e![]() ﹣ =Ni(OH) 2 +OH ﹣ ;负极电极反应为:MH+OH ﹣ ﹣e ﹣ =M+H 2 O;
﹣ =Ni(OH) 2 +OH ﹣ ;负极电极反应为:MH+OH ﹣ ﹣e ﹣ =M+H 2 O;
②阴极上是氧气发生的电子的过程,电极反应式为:O 2 +2H 2 O+4e ﹣ =4OH ﹣ ,
故答案为:1:1;MH+OH ﹣ ﹣e ﹣ =M+H 2 O;O 2 +2H 2 O+4e ﹣ =4OH ﹣ ;
(2)①用Na 2 SO 4 溶液吸收SO 2 ,再用离子膜电解法电解吸收液得到单质硫,依据氢离子移动方向可知,a为阴极,b为阳极,b电极链接电源正极;
故答案为:正极;
②用Na 2 SO 4 溶液代替水吸收烟气中的SO 2 使之转化为H 2 SO 3 ,提高溶液导电性,加快电解速率,故答案为:提高溶液导电性,加快电解速率;
③电解池中阴极是二氧化硫得到电子生成硫单质,电极反应为:SO 2 +4H + +4e ﹣ =S+2H 2 O,故答案为:SO 2 +4H + +4e ﹣ =S+2H 2 O.
【点评】 本题考查了氧化还原反应方向,原电池、电解池原理的理解应用,离子方程式书写,掌握基础是关键,题目难度中等.
某溶液中含cl-、Br-、I-的物质的量分别为0.1mol、0.2mol、0.3mol.现通入氯气 2020-05-17 …
如图1表示氮及其化合物在一定条件下的转化关系:(1)反应I:N2(g)+3H2(g)⇌2NH3(g 2020-07-23 …
1.请问(2+i)^2/(1-i)在复数平面上对应的点位于第几象限,1.请问(2+i)^2/(1- 2020-08-01 …
已知z(1+i)2=1-i(i为虚数单位),则复数z在复平面内对应的点的坐标是()A.(2,-2) 2020-08-01 …
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如图:已知:反应II包含2NaHSO3═ 2020-11-01 …
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如图:已知:反应II包含2NaHSO3═ 2020-11-01 …
汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程可用如图表示.下列有关说法正确的是() 2020-11-01 …
化学反应原理在科研和生产中有广泛应用。(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I 2020-11-01 …
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如下:已知:反应Ⅱ包含2NaHSO3加热 2020-12-05 …
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如下:已知:反应Ⅱ包含2NaHSO3Na 2021-01-12 …