早教吧作业答案频道 -->化学-->
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.(1)溴元素在周期表中的位置为.(2)下列说法中正确的是.A.CCl4和XeF2分子中各原子最外层均满足8e-结构B.Cl2O5
题目详情
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
(1)溴元素在周期表中的位置为___.
(2)下列说法中正确的是___.
A.CCl4和XeF2分子中各原子最外层均满足8e-结构
B.Cl2O5和Cl2O7都是酸性氧化物
C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强
(3)已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃.HF的电子式为___;从HF、HCl混合气体中分离出HF的方法是___.
(4)向NaClO浓溶液中加入Al2(SO4)3浓溶液,迅速生成大量白色沉淀,同时有无色气体产生.生成白色沉淀的离子方程式为___.无色气体的成分为___.
(5)潮湿的氯气与碳酸钠粉末反应可用于制取氯的最低价氧化物,反应还同时生成两种盐,该反应的化学方程式为___.
(6)已知:还原性HSO3¯>I¯,氧化性IO3¯>I2,在如图中画出向含3mol NaHSO3的溶液中逐滴加入KIO3溶液的过程中,析出I2的物质的量与KIO3的物质的量之间关系的曲线___.

(1)溴元素在周期表中的位置为___.
(2)下列说法中正确的是___.
A.CCl4和XeF2分子中各原子最外层均满足8e-结构
B.Cl2O5和Cl2O7都是酸性氧化物
C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强
(3)已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃.HF的电子式为___;从HF、HCl混合气体中分离出HF的方法是___.
(4)向NaClO浓溶液中加入Al2(SO4)3浓溶液,迅速生成大量白色沉淀,同时有无色气体产生.生成白色沉淀的离子方程式为___.无色气体的成分为___.
(5)潮湿的氯气与碳酸钠粉末反应可用于制取氯的最低价氧化物,反应还同时生成两种盐,该反应的化学方程式为___.
(6)已知:还原性HSO3¯>I¯,氧化性IO3¯>I2,在如图中画出向含3mol NaHSO3的溶液中逐滴加入KIO3溶液的过程中,析出I2的物质的量与KIO3的物质的量之间关系的曲线___.
▼优质解答
答案和解析
(1)溴元素的原子序数为35,原子结构中有4个电子层、最外层电子数为7,则溴元素在第四周期第ⅦA族,故答案为:第四周期第ⅦA族;
(2)A.CCl4中碳和氯原子最外层满足8电子,XeF2分子中Xe最外层不是8e-结构,故A不选;
B.Cl2O5对应的酸是氯酸,Cl2O7对应的是高氯酸,二者都是酸性氧化物,故B选;
C.氟非金属性强于氯,但氢氟酸的酸性弱于盐酸,故C不选;
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强,故D选;
故答案为:BD;
(3)氟化氢中氟原子和氢原子之间形成一对共用电子,所以电子式为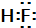 ;因为二者的沸点差距较大,所以可以用冷凝的方法,氯化氢变成液体,从而得到氟化氢气体,
;因为二者的沸点差距较大,所以可以用冷凝的方法,氯化氢变成液体,从而得到氟化氢气体,
故答案为: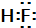 ;冷凝;
;冷凝;
(4)NaClO浓溶液中加入Al2(SO4)3溶液,发生双水解生成氢氧化铝白色沉淀和次氯酸,次氯酸会分解成氧气和盐酸,所以离子方程式为3ClO-+Al3++3H2O=3HClO+Al(OH)3↓,次氯酸分解生成O2、HCl,
故答案为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;O2、HCl;
(5)氯的最低价氧化物为一氧化二氯,氯元素化合价升高,所以有氯元素化合价降低到氯化钠,同时还有碳酸氢钠生成,所以方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,故答案为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;
(6)向亚硫酸氢钠中滴加碘酸钾,发生反应为:3HSO3-+IO3-=3SO42-+I-+3H+,当亚硫酸氢根消耗完,再滴加碘酸钾,又发生反应为:IO3-+5I-+6H+=3I2+3H2O,所以一段时间后才有碘单质生成,则析出I2的物质的量与KIO3的物质的量之间关系的曲线为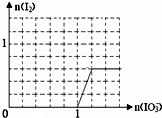 ,
,
故答案为: .
.
(2)A.CCl4中碳和氯原子最外层满足8电子,XeF2分子中Xe最外层不是8e-结构,故A不选;
B.Cl2O5对应的酸是氯酸,Cl2O7对应的是高氯酸,二者都是酸性氧化物,故B选;
C.氟非金属性强于氯,但氢氟酸的酸性弱于盐酸,故C不选;
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强,故D选;
故答案为:BD;
(3)氟化氢中氟原子和氢原子之间形成一对共用电子,所以电子式为
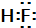 ;因为二者的沸点差距较大,所以可以用冷凝的方法,氯化氢变成液体,从而得到氟化氢气体,
;因为二者的沸点差距较大,所以可以用冷凝的方法,氯化氢变成液体,从而得到氟化氢气体,故答案为:
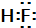 ;冷凝;
;冷凝;(4)NaClO浓溶液中加入Al2(SO4)3溶液,发生双水解生成氢氧化铝白色沉淀和次氯酸,次氯酸会分解成氧气和盐酸,所以离子方程式为3ClO-+Al3++3H2O=3HClO+Al(OH)3↓,次氯酸分解生成O2、HCl,
故答案为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;O2、HCl;
(5)氯的最低价氧化物为一氧化二氯,氯元素化合价升高,所以有氯元素化合价降低到氯化钠,同时还有碳酸氢钠生成,所以方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,故答案为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;
(6)向亚硫酸氢钠中滴加碘酸钾,发生反应为:3HSO3-+IO3-=3SO42-+I-+3H+,当亚硫酸氢根消耗完,再滴加碘酸钾,又发生反应为:IO3-+5I-+6H+=3I2+3H2O,所以一段时间后才有碘单质生成,则析出I2的物质的量与KIO3的物质的量之间关系的曲线为
 ,
,故答案为:
 .
.
看了在生产生活中,卤族元素(F、C...的网友还看了以下:
8□523≈9万,□里应填()A.小于5的数B.大于5的数C.等于5的数D.大于等于5的数 2020-04-07 …
红磷燃烧液面上升大于1/5的原因 2020-05-02 …
数轴上表示2.5的点A到原点的距离为多少,表示-2.5的点B到原点距离为多少,AB两点之间的距离为 2020-05-16 …
数轴上,表示2.5的点A到原点的距离为(),表示-2.5的点B到原点的距离为(),A、B两点之间的 2020-05-16 …
红磷在氧气中燃烧导致空气大于或小于1/5的原因是求求求求 2020-05-21 …
勾2股4玄5的原理急用过了今天就没用了...是勾3.有人知道吗? 2020-05-22 …
求x^2/(x^2+a^2)^1..5的原函数,dx的,a是常数 2020-05-22 …
为了保证填土工程的质量,不可选用的土料有( )。A.硫酸盐含量小于5%的土B.硫酸盐含量大于5 2020-06-07 …
算式-3-5不能读作()A.-3与-5的差B.-3与5的差C.3的相反数与5的差D.-3减去5 2020-06-17 …
若映射f把R中的元素x映射到R中的元素x平方+1,则元素5的原象是 2020-06-20 …