早教吧作业答案频道 -->化学-->
氮族元素(Nitrogengroup)是元素周期表ⅤA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种.(1)氮族元素的外围电子排布式的通式为;基态磷原子中,
题目详情
氮族元素(Nitrogen group)是元素周期表ⅤA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种.
(1)氮族元素的外围电子排布式的通式为___;基态磷原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___.
(2)PH3分子的VSEPR模型为___,键角NH3___H2O(填“>”、“<”或“=”).
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为___.
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是___.
②NH3易与Cu2+反应,而NF3却不能,其原因是___.
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则磷原子的配位数为___;已知磷化硼的晶胞边长a=478pm,计算晶体中硼原子和磷原子的核间距(dB-P)=___pm(保留三位有效数字)
(1)氮族元素的外围电子排布式的通式为___;基态磷原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___.
(2)PH3分子的VSEPR模型为___,键角NH3___H2O(填“>”、“<”或“=”).
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为___.
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是___.
②NH3易与Cu2+反应,而NF3却不能,其原因是___.
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则磷原子的配位数为___;已知磷化硼的晶胞边长a=478pm,计算晶体中硼原子和磷原子的核间距(dB-P)=___pm(保留三位有效数字)
▼优质解答
答案和解析
(1)氮族元素的外围电子为其最外层上s、p能级电子,则氮族元素外围电子排布式为ns2np3;
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,所以有9个轨道,
故答案为:ns2np3;M;9;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型为四面体形,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,氨气分子中只含一个孤电子对、水分子中含有两个孤电子对,所以键角,故答案为:四面体形;>;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为
=2,根据价层电子对互斥理论判断原子杂化方式为sp,
故答案为:sp;
(4)①NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,
故答案为:NH3能形成氢键,NF3只有范德华力;
②F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示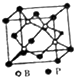 ,该晶胞中B原子为4个、P原子个数=8×
,该晶胞中B原子为4个、P原子个数=8×
+6×
=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的
=
×
a=
×
×478pm=207pm,
故答案为:207.
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,所以有9个轨道,
故答案为:ns2np3;M;9;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型为四面体形,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,氨气分子中只含一个孤电子对、水分子中含有两个孤电子对,所以键角,故答案为:四面体形;>;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为
| 5-1 |
| 2 |
故答案为:sp;
(4)①NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,
故答案为:NH3能形成氢键,NF3只有范德华力;
②F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示
 ,该晶胞中B原子为4个、P原子个数=8×
,该晶胞中B原子为4个、P原子个数=8×| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
| 3 |
| 1 |
| 4 |
| 3 |
故答案为:207.
看了氮族元素(Nitrogengr...的网友还看了以下:
不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n(n=1,3,5,7;且非金属 2020-05-13 …
小部分的水和无机盐和尿素通过 ( )以( )的形式排出 大部分的水和无机盐和尿素通过 ( )以( 2020-05-14 …
人体排泄的主要途径是:大部分的水、无机盐和尿素通过以的形式排出;小部分的水、无机盐和尿素通过以的形 2020-06-30 …
根据元素化合价书写化学式时,要求1、正价元素通常写在右边,负价元素写在左边2、原子的数目用阿拉伯数 2020-07-29 …
杨辉三角通项公式在杨辉三角中如何用通项公式表示n行m列的元素?通项公式是如何推导的?不要说通过观察 2020-08-01 …
下列说法中不正确的是()A.糖类是有甜味的物质B.糖类组成不一定符合通式Cm(H2O)nC.糖类是人 2020-10-31 …
氮族元素(Nitrogengroup)是元素周期表ⅤA族的所有元素,包括氮(N)、磷(P)、砷(As 2020-11-01 …
下列说法中不正确的是()A.糖类是有甜味的物质B.糖类组成不一定符合通式Cm(H2O)nC.糖类是人 2020-11-07 …
含碳、氢、氧元素的下列有机物分子式通式:A.Cn(H2O)mB.含碳、氢、氧元素的下列有机物分子式通 2020-11-07 …
请问“淀粉,纤维素可能互为同分异构体”这句话怎么错了?淀粉纤维素通式是(C6H10O5)n当n一样时 2020-12-01 …