早教吧作业答案频道 -->化学-->
氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题:(1)基态磷原子有种不同能量的电子.(2)N、P、As电负性由大到小的顺序为,它们的氢化物沸点最高的
题目详情
氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题:
(1)基态磷原子有___种不同能量的电子.
(2)N、P、As电负性由大到小的顺序为___,它们的氢化物沸点最高的为___,原因为___.
(3)NO3-离子的空间构型为___,中心原子的杂化方式为___,NO3-离子有多种等电子体,请写出一种___.
(4)钛元素原子核外价电子排布图为___,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为___,该配离子的配位数为___.
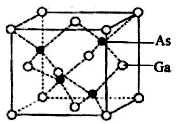
(5)砷化镓晶胞结构如图.晶胞中距离Ga原子等距且最近的Ga原子有___个,Ga与周围等距且最近的As形成的空间构型为___.已知砷化镓晶胞边长为a pm,其密度为ρg•cm-3,则阿伏加德罗常数的数值为___(列出计算式即可).

(1)基态磷原子有___种不同能量的电子.
(2)N、P、As电负性由大到小的顺序为___,它们的氢化物沸点最高的为___,原因为___.
(3)NO3-离子的空间构型为___,中心原子的杂化方式为___,NO3-离子有多种等电子体,请写出一种___.
(4)钛元素原子核外价电子排布图为___,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为___,该配离子的配位数为___.
(5)砷化镓晶胞结构如图.晶胞中距离Ga原子等距且最近的Ga原子有___个,Ga与周围等距且最近的As形成的空间构型为___.已知砷化镓晶胞边长为a pm,其密度为ρg•cm-3,则阿伏加德罗常数的数值为___(列出计算式即可).
▼优质解答
答案和解析
(1)磷原子核外有5个不同的能级,即有5种不同能量的电子,故答案为:5;
(2)N、P、As非金属性强弱顺序为N>P>As,则N、P、As电负性由大到小的顺序为N>P>As;NH3、PH3、AsH3中沸点最高的是NH3,因为NH3分子间形成氢键;故答案为:N>P>As;NH3;NH3分子间形成氢键;
(3)NO3-中N原子价层电子对=3+
(5+1-3×2)=3,且不含孤电子对,为sp2杂化,所以是平面三角形结构,与NO3-互为等电子体的有:CO32-(SO3、BF3等),故答案为:平面正三角形;sp2;CO32-(SO3、BF3等);
(4)基态Ti原子的电子排布式为Is22s22p63S23p63d24s2(或[Ar]3d24s2),则原子核外价电子排布图为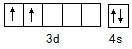 ;配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,
;配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,
故答案为: ;极性共价键、配位键;6;
;极性共价键、配位键;6;
(5)由晶胞结构可知与晶胞顶点Ga等距离且最近的Ga为晶胞表面中心Ga,则晶胞中距离Ga原子等距且最近的Ga原子有12个,Ga与周围等距且最近的As的原子个数为4,形成的空间构型为正四面体;晶胞中含有Ga的原子数为8×
+6×
=4,As的原子个数为4,则晶胞的质量为
g,晶胞的体积为(a×10-10)3cm3,则晶胞的密度ρg•cm-3=
g÷(a×10-10)3cm3,则NA=
;
故答案为:12;正四面体;
.
(2)N、P、As非金属性强弱顺序为N>P>As,则N、P、As电负性由大到小的顺序为N>P>As;NH3、PH3、AsH3中沸点最高的是NH3,因为NH3分子间形成氢键;故答案为:N>P>As;NH3;NH3分子间形成氢键;
(3)NO3-中N原子价层电子对=3+
| 1 |
| 2 |
(4)基态Ti原子的电子排布式为Is22s22p63S23p63d24s2(或[Ar]3d24s2),则原子核外价电子排布图为
 ;配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,
;配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,中心离子是Ti3+,提供空轨道接受孤对电子,H2O、Cl-提供孤电子对为配体,2个氨气分子,所以配位数为6,故答案为:
 ;极性共价键、配位键;6;
;极性共价键、配位键;6;(5)由晶胞结构可知与晶胞顶点Ga等距离且最近的Ga为晶胞表面中心Ga,则晶胞中距离Ga原子等距且最近的Ga原子有12个,Ga与周围等距且最近的As的原子个数为4,形成的空间构型为正四面体;晶胞中含有Ga的原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×145 |
| NA |
| 4×145 |
| NA |
| 4×145 |
| ρa3×10-30 |
故答案为:12;正四面体;
| 4×145 |
| ρa3×10-30 |
看了氮、磷、砷、钛的单质及其化合物...的网友还看了以下:
高压下氮气聚合生成高聚氮,其晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状 2020-04-09 …
2004年7月,德俄两国科学家共同宣布,在高压下氮气会聚合成高聚氮晶体,该晶体中相邻氮原子间以氮氮 2020-04-09 …
一个由n条多钛链组成的蛋白质分子共有m个氨基酸,该蛋白质分子完全水解共需多少个水分子()A.n个B 2020-05-14 …
(2013•江西二模)氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件 2020-05-14 …
化学式用英语怎么读?比如TiN氮化钛,CrN氮化烙 2020-05-22 …
氮原子有取代基的有机化合物命名问题.氮原子有取代基的话记为N-x(x为取代基),有的N-x在前边如 2020-06-23 …
氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化 2020-07-06 …
金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度.其单质和化合 2020-07-07 …
将充有N毫升一氧化氮和M毫升二氧化氮的试管倒立于盛水的水槽中,然后通入N毫升氧气.M>N,则充分反 2020-07-09 …
2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都 2020-07-12 …