早教吧作业答案频道 -->化学-->
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含Al、Li、Co2O3和Fe2O3等物质)已知:①物质溶解性:LiF难溶于水;LiCO3微溶于水;CoCO3难溶
题目详情
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含Al、Li、Co2O3和Fe2O3等物质)
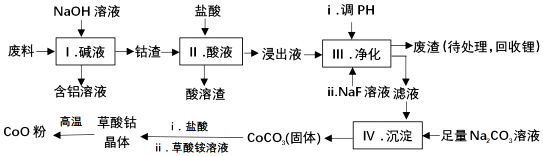
已知:①物质溶解性:LiF难溶于水;LiCO3微溶于水;CoCO3难溶于水
②部分金属离子形成氢氧化物沉淀的pH见表一.
表一:
请回答:
(1)I中得到含铝溶液的反应离子方程式是___.
(2)I中得到钴渣的实验操作是___(填操作名称).
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:___.
(4)步骤Ⅲ中调节溶液的pH时,pH的范围是___
(5)废渣中的主要成分有___,___.步骤Ⅲ中加入NaF溶液,对步骤Ⅳ所起的作用是___.
(6)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表二.已知=183g/mol
表二:
①加热到210℃时,固体物质的化学式为:___
②经测定,加热到210~310℃过程中生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:___.

已知:①物质溶解性:LiF难溶于水;LiCO3微溶于水;CoCO3难溶于水
②部分金属离子形成氢氧化物沉淀的pH见表一.
表一:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)I中得到含铝溶液的反应离子方程式是___.
(2)I中得到钴渣的实验操作是___(填操作名称).
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:___.
(4)步骤Ⅲ中调节溶液的pH时,pH的范围是___
(5)废渣中的主要成分有___,___.步骤Ⅲ中加入NaF溶液,对步骤Ⅳ所起的作用是___.
(6)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表二.已知=183g/mol
表二:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
②经测定,加热到210~310℃过程中生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:___.
▼优质解答
答案和解析
(1)步骤Ⅰ中得到含铝溶液是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)I中通过过滤得到钴渣和含铝滤液,故答案为:过滤;
(3)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(4)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH范围为3.2≤PH<7.15,
故答案为:3.2≤PH<7.15;
(5)III中调节pH,加入NaF溶液净化,除去锂离子和铁离子,废渣中的主要成分为LiF和Fe(OH)3;其中NaF溶液,降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀;
故答案为:Fe(OH)3;LiF;降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀;
(6)①(5))①计算晶体物质的量n=
=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150℃~210℃固体质量变化5.49g-4.41g=1.08g,说明210℃失去结晶水得到CoC2O4;
故答案为:CoC2O4;
②210~310℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
=0.02mol,则:
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2
Co3O4+6CO2;
故答案为:3CoC2O4+2O2
Co3O4+6CO2.
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)I中通过过滤得到钴渣和含铝滤液,故答案为:过滤;
(3)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(4)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH范围为3.2≤PH<7.15,
故答案为:3.2≤PH<7.15;
(5)III中调节pH,加入NaF溶液净化,除去锂离子和铁离子,废渣中的主要成分为LiF和Fe(OH)3;其中NaF溶液,降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀;
故答案为:Fe(OH)3;LiF;降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀;
(6)①(5))①计算晶体物质的量n=
| 5.49g |
| 183g/mol |
故答案为:CoC2O4;
②210~310℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
| 0.064g |
| 32g/mol |
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2
| ||
故答案为:3CoC2O4+2O2
| ||
看了钴(Co)及其化合物在工业上有...的网友还看了以下:
翻译物理演示实验的教学是物理课程和物理教学的一个重要的组成部分.它既是物理教学的重要基础,又是物理物 2020-03-30 …
当F浮——G物时,物体上浮,(p物——p液)上浮的最终结果是物体处于漂浮状态,当物体漂浮时,F浮— 2020-05-16 …
∵EM是⊙O的切线,怎么推出EB•EC=EM2①?,看题后回答.(2005•温州)如图,已知四边形 2020-05-21 …
“以物物物,则物可物,以物物非物,则物非物,物不得名之功,名不得物之实,名物不是,是以物无物也”的 2020-06-16 …
(2009•杭州)如图,有一个圆O和两个正六边形T1,T2.T1的6个顶点都在圆周上,T2的6条边 2020-08-03 …
大气臭氧层的反应是:O+O3=2O2△H,该反应的能量变化如图所示,下列叙述中,正确的是()A.O+ 2020-10-31 …
[物理-物理3-5](1)物理学家常常根据物理实验观察到的现象提出假设,并用假设解释一些物理现象,进 2021-01-04 …
物理—物理3-5(1)物理学家常常根据物理实验观察到的现象提出假设,并用假设解释一些物理现象,进而建 2021-01-04 …
已知A,B两点在抛物线C:x^2=4Y上,点M(0,4)满足向量MA=K向量BM.1)求证:向量已知 2021-02-05 …
XX,我想对你说谁能帮我填上这两字?要写起来方便能写到600字动物人物设么都可以要求题材新颖别老是妈 2021-02-06 …