早教吧作业答案频道 -->化学-->
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;②部
题目详情
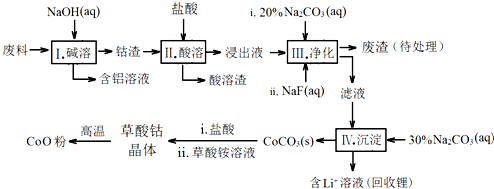
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是___.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式___
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___.废渣中的成分有___.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是___.
(6)某锂离子电池的总反应为C+LiCoO2
LixC+Li1-xCoO2,LixC中Li的化合价为___价,该锂离子电池充电时阳极的电极反应式为___.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是___.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式___
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过___.废渣中的成分有___.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是___.
(6)某锂离子电池的总反应为C+LiCoO2
| 充电 |
| |
| 放电 |
▼优质解答
答案和解析
(1)步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分为LiF和Fe(OH)3;
故答案为:7.15; LiF,Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)210℃~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
=0.02mol,则:
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2
Co3O4+6CO2;
故答案为:3CoC2O4+2O2
Co3O4+6CO2;
(6)LiCoO2中锂元素化合价为+1价,则依据放电为原电池反应,锂元素化合价升高发生氧化反应分析判断,LixC中锂元素化合价为0价,是锂单质镶嵌在碳中做原电池负极,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe-=Li1-xCoO2 +xLi+,C为阴极得电子发生还原反应:C+xe-+xLi+=LixC,
故答案为:0,LiCoO2-xe-=Li1-xCoO2+xLi+;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分为LiF和Fe(OH)3;
故答案为:7.15; LiF,Fe(OH)3;
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
故答案为:降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5)210℃~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=
| 0.064g |
| 32g/mol |
n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2
| ||
故答案为:3CoC2O4+2O2
| ||
(6)LiCoO2中锂元素化合价为+1价,则依据放电为原电池反应,锂元素化合价升高发生氧化反应分析判断,LixC中锂元素化合价为0价,是锂单质镶嵌在碳中做原电池负极,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe-=Li1-xCoO2 +xLi+,C为阴极得电子发生还原反应:C+xe-+xLi+=LixC,
故答案为:0,LiCoO2-xe-=Li1-xCoO2+xLi+;
看了钴(Co)及其化合物在工业上有...的网友还看了以下:
把力F进行分解,下列的说法中正确的有()A.已知两个分力的方向,有惟一的解B.已知两个分力的大小,有 2020-03-30 …
已知定义在R上的奇函数f(x)满足f(x+2e)=-f(x)(其中e=2.7182…),且在区间[ 2020-04-06 …
(2010•郑州二模)已知函数f(x)满足f(x)=f(π-x),且当x∈(-π2,π2)时,f( 2020-05-14 …
已知M是满足下列性质的所有函数f(x)组成的集合:对于函数f(x),使得对函数f(x)定义域内的任 2020-05-17 …
1、已知,映射A={1,2,3},B={4,5,6},f:A→B满足1是4的一个原象,这样的映射共 2020-05-23 …
已知a为常数,函数f(x)=x(lnx-ax)有两个极值点x1,x2(x1<x2),则()A.f( 2020-06-08 …
已知函数f(x)在R上可导,其导函数为f′(x),若f(x)满足:(x-1)[f′(x)-f(x) 2020-06-08 …
甲、乙两个身高相同的人抬着一个木箱沿斜坡上山,木箱的悬点恰好在抬杠的中央.如图所示,则甲、乙两人所 2020-06-12 …
已如f(x)是定义在R上的偶函数,且满足f(x+2)=f(x),当x∈[0,1]时,f(x)=2x 2020-06-27 …
已知f(x)是定义在[-2,2]上的奇函数,且f(2)=3.若对任意的m,n∈[-2,2],m+n 2020-07-01 …